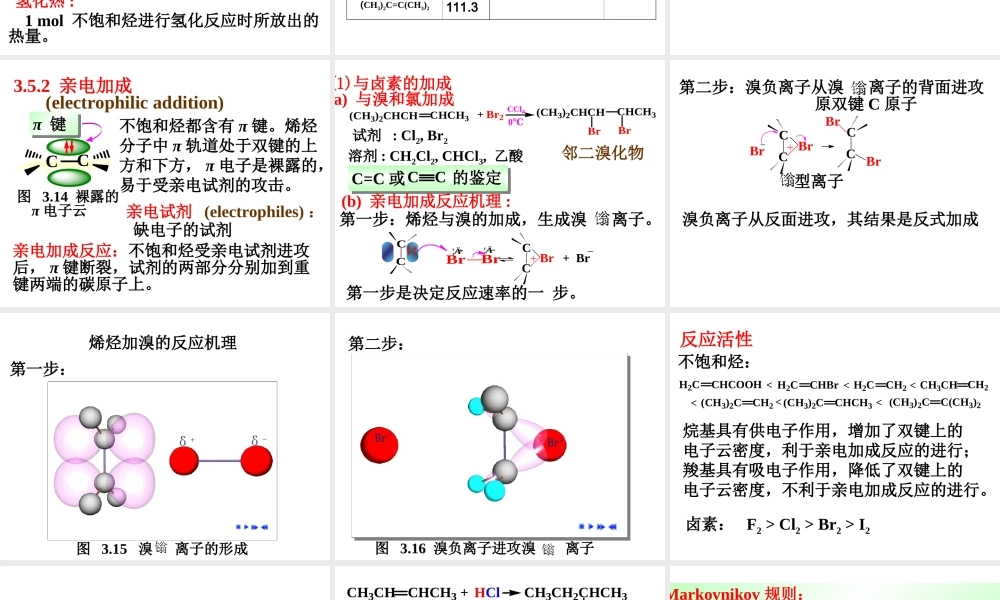
烯烃的化学性质3.5.1催化加氢CC+H2´ß»¯¼ÁCCHHÊÒÎÂ催化剂:Pt,Pd,Ni烯烃在催化剂存在下,与氢气进行加成反应,生成烷烃:催化氢化反应反应特点:•相对反应活性烯烃:H2CCH2>RCHCH2>RCHCHRR2CCH2>R2CCHR>R2CCR2氢化热:1mol不饱和烃进行氢化反应时所放出的热量。反应特点:•相对反应活性烯烃:H2CCH2>RCHCH2>RCHCHRR2CCH2>R2CCHR>R2CCR2•立体选择性:烯烃的催化加氢反应——顺式加成CH3CH3H2,PtCH3CH3HHCH3COOH70%~85%•催化剂的作用降低反应的活化能。E2>E1E1E2有催化剂无催化剂CC+H2CCHH反应进程能量图3.12烯烃氢化反应的能量变化图•放热反应键的断裂:π键,H-Hσ键键的形成:2C-Hσ键氢化热:1mol不饱和烃进行氢化反应时所放出的热量。氢化热与不饱和烃的稳定性相关:氢化热越高,不饱和烃的稳定性则越低。烯烃氢化热烯烃氢化热CH2=CH2137.2顺CH3CH2CH=CHCH3119.7CH3CH=CH2125.9反CH3CH2CH=CHCH3115.5(CH3)2C=CH2118.8顺CH3CH=CHCH3119.7(CH3)2C=CHCH3112.5反CH3CH=CHCH3115.5(CH3)2C=C(CH3)2111.3结论:稳定性:1.反式>顺式2.双键碳连烷基数目越多越稳定R2C=CR2>R2C=CHR>R2C=CH2RCH=CHR>RCH=CH2>CH2=CH23.5.2亲电加成(electrophilicaddition)不饱和烃都含有π键。烯烃分子中π轨道处于双键的上方和下方,π电子是裸露的,易于受亲电试剂的攻击。亲电试剂(electrophiles):缺电子的试剂亲电加成反应:不饱和烃受亲电试剂进攻后,π键断裂,试剂的两部分分别加到重键两端的碳原子上。CC图3.14裸露的π电子云π键π键(1)与卤素的加成a)与溴和氯加成C=C或CC的鉴定(CH3)2CHCHCHCH3+Br2CCl4(CH3)2CHCHCHCH3BrBr0℃邻二溴化物溶剂:CH2Cl2,CHCl3,乙酸试剂:Cl2,Br2(b)亲电加成反应机理:BrBr¦Ä¦ÄCCBr+BrCC第一步是决定反应速率的一步。第一步:烯烃与溴的加成,生成溴离子。CCBrBrCCBrBr第二步:溴负离子从溴离子的背面进攻原双键C原子型离子溴负离子从反面进攻,其结果是反式加成烯烃加溴的反应机理第一步:图3.15溴离子的形成第二步:图3.16溴负离子进攻溴离子反应活性不饱和烃:H2CCH2CH3CHCH2(CH3)2CCH2(CH3)2CCHCH3(CH3)2CC(CH3)2H2CCHCOOHH2CCHBr<<<<<<烷基具有供电子作用,增加了双键上的电子云密度,利于亲电加成反应的进行;羧基具有吸电子作用,降低了双键上的电子云密度,不利于亲电加成反应的进行。卤素:F2>Cl2>Br2>I2(2)与卤化氢加成Markovnikov规则(a)与卤化氢加成CC+HXCCHX卤代烷烯烃与卤化氢的加成,生成卤代烷。+H...