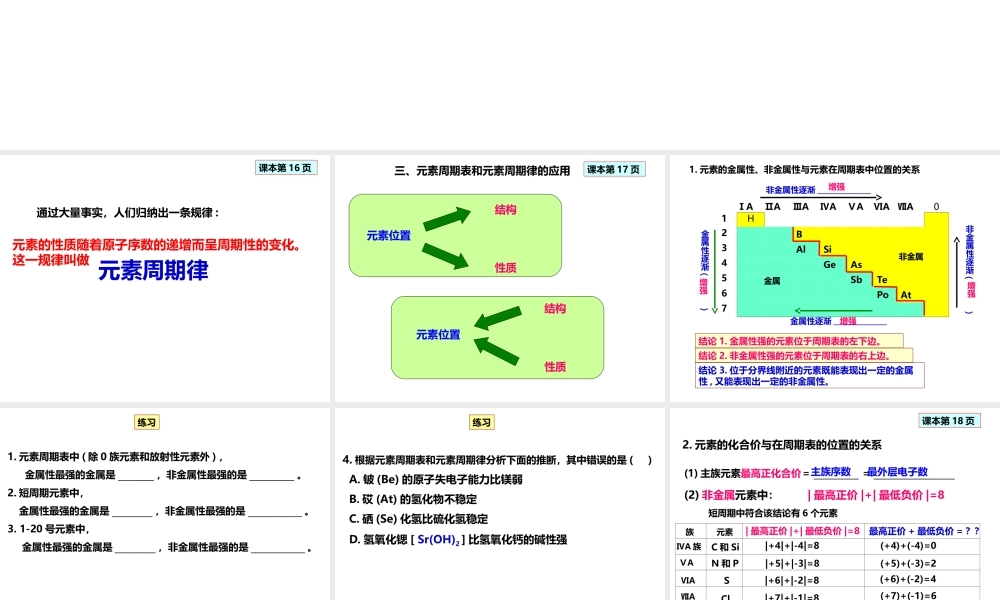
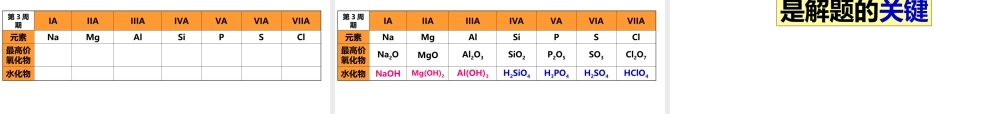
第二节元素周期律第3课时元素周期律的应用课本第16页通过大量事实,人们归纳出一条规律:元素的性质随着原子序数的递增而呈周期性的变化。这一规律叫做元素周期律元素位置结构性质元素位置结构性质课本第17页三、元素周期表和元素周期律的应用1.元素的金属性、非金属性与元素在周期表中位置的关系ⅠAⅡAⅢAⅣAⅤAⅥAⅦA01H2B3AlSi4GeAs5SbTe6PoAt7结论1.金属性强的元素位于周期表的左下边。非金属金属非金属性逐渐_____________金属性逐渐_____________非金属性逐渐()金属性逐渐()增强增强增强增强结论2.非金属性强的元素位于周期表的右上边。结论3.位于分界线附近的元素既能表现出一定的金属性,又能表现出一定的非金属性。1.元素周期表中(除0族元素和放射性元素外),金属性最强的金属是________,非金属性最强的是__________。2.短周期元素中,金属性最强的金属是_________,非金属性最强的是____________。3.1-20号元素中,金属性最强的金属是_________,非金属性最强的是____________。练习4.根据元素周期表和元素周期律分析下面的推断,其中错误的是()A.铍(Be)的原子失电子能力比镁弱B.砹(At)的氢化物不稳定C.硒(Se)化氢比硫化氢稳定D.氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强练习(2)非金属元素中:短周期中符合该结论有6个元素课本第18页2.元素的化合价与在周期表的位置的关系(1)主族元素最高正化合价=__________=__________________主族序数最外层电子数|最高正价|+|最低负价|=8|最高正价|+|最低负价|=8C和Si|+4|+|-4|=8N和P|+5|+|-3|=8S|+6|+|-2|=8Cl|+7|+|-1|=8(+4)+(-4)=0(+5)+(-3)=2(+6)+(-2)=4(+7)+(-1)=6ⅣA族ⅤAⅥAⅦA族元素最高正价+最低负价=??课本第18页在氧化物中或含氧酸中在氢化物中|最高正价|+|最低负价|=8(3)解题还需要的常识:一般来说,元素正价一般在什么物质中?____________________________元素负价一般在什么物质中?____________________________5.某元素的最高正价与最低负价的代数和为4,则该元素原子的最外层电子()A.4B.5C.6D.7练习6.某元素X的最高价氧化物对应水化物的化学式为HXO4,则其气态氢化物的化学式为_______________练习7.某元素X的气态氢化物化学式为H2X,下面的叙述不正确的是()A.该元素的原子最外层上有6个电子B.该元素最高价氧化物的化学式为XO3C.该元素是非金属元素D.该元素最高价氧化物对应水化物的化学式为H2XO3练习(1)预测未知物的位置与性质。3.元素周期律、元素周期表的应用8.砹(A...