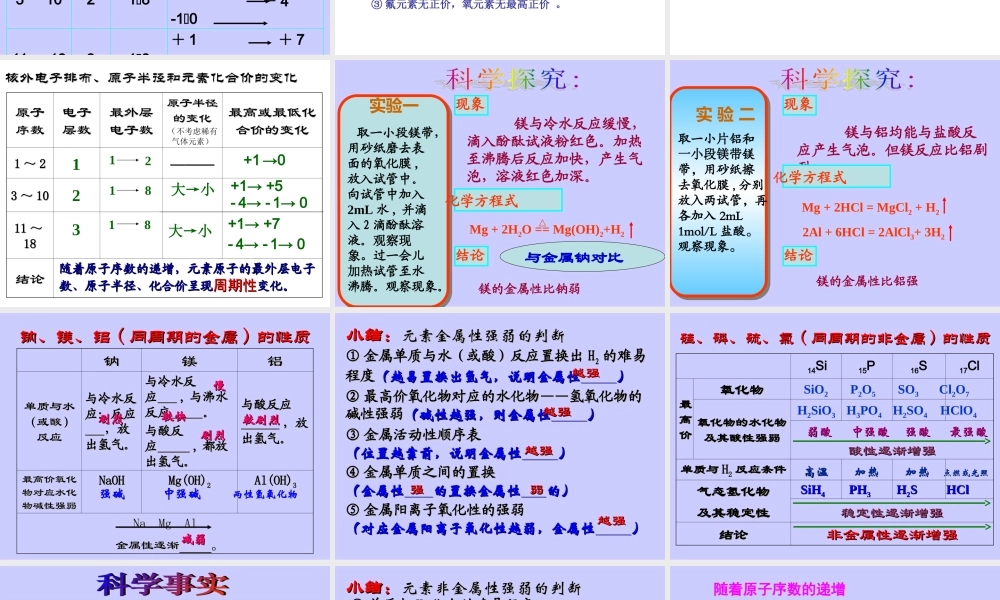
第三课时元素周期律第一章物质结构元素周期律第二节元素周期律学科网越大越大越大⑵电子层数相同时,再看核电荷数,核电荷数越少,则半径⑶电子层数和核电荷数都相同(同种元素)时,再看核外电子数(或最外层电子数),核外电子数(或最外层电子数越多),则半径微粒半径大小比较规律⑴先看电子层数,电子层数越多,则半径一般情况下(稀有气体除外):如LiNaKRbCsIBrClF<<<<>>>>如NaMgAl>FONC<<<如ClCl-<下列各组微粒半径大小比较中,不正确的是()A.r(K+)>r(K)B.r(Mg2+)>r(Na+)>r(F-)C.r(Na+)>r(Mg2+)>r(Al3+)D.r(Cl-)>r(F-)>r(F)AB小结:(1)比较微粒半径大小:三看一看电子层数二看核电荷数三看核外电子数或最外层电子数(2)对于同种元素:(3)对于电子层结构相同的离子:核电荷数越大,则离子半径越小。如O2-F-Na+Mg2+Al3+;S2-Cl-K+Ca2+>>>>>>>①阳离子半径<原子半径②阴离子半径>原子半径表5-51-18号元素的核外电子排布、原子半径和主要化合价主要化合价:正价+1→0主要化合价:正价+1→+5,负价:-4→-1→0主要化合价:正价+1→+7,负价:-4→-1→0学科网P.14~15科学探究1运用核外电子排布规律结合前三周期元素的原子结构示意图,然后分析、归纳出各周期元素的最外层电子排布和主要化合价的递变规律。原子序数电子层数最外层电子数主要化合价1-2112+103-10218+1+5-4-101118318+1+7常见元素化合价的一般规律①1~20号元素中,除了O、F外,最高正价=最外层电子数;最低负价与最高正价的关系为:最高正价+︱最低负价︱=8{②金属元素无负价(除零价外,在化学反应中只显正价);既有正价又有负价的元素一定是非金属元素;③氟元素无正价,氧元素无最高正价。某元素最高价含氧酸的化学式为HXO4,这种元素的气态氢化物的化学式是()A、HXB、H2XC、XH3D、XH4A原子原子序数序数电子电子层数层数最外层最外层电子数电子数原子半径原子半径的变化的变化(不考虑稀有气体元素)最高或最低化最高或最低化合价的变化合价的变化11~~22——————33~~10101111~~1818结论结论123121818大→小+1→0+1→+5-4→-1→0随着原子序数的递增,元素原子的最外层电子随着原子序数的递增,元素原子的最外层电子数、原子半径、化合价呈现数、原子半径、化合价呈现周期性周期性变化。变化。核外电子排布、原子半径和元素化合价的变化核外电子排布、原子半径和元素化合价的变化大→小+1→+7-4→-1→0取一小段镁带,用砂纸磨去表面的氧化膜,放入...