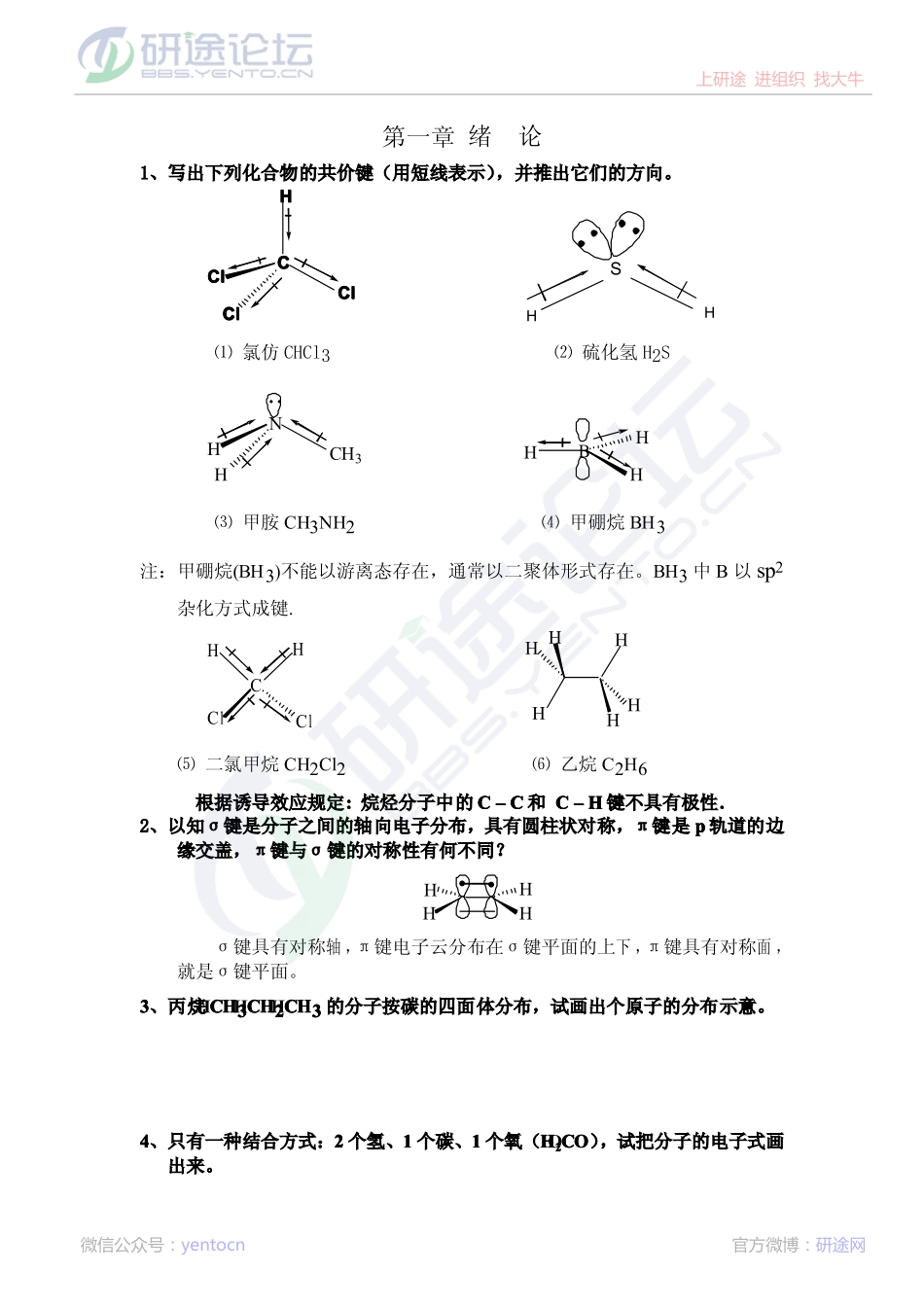
第一章绪论1、写出下列化合物的共价键(用短线表示),并推出它们的方向。HHHHCCCCllllCCCCllllCCCCllllCCCCSHH⑴氯仿CHCl3⑵硫化氢H2SNHCH3HBHHH⑶甲胺CH3NH2⑷甲硼烷BH3注:甲硼烷(BH3)不能以游离态存在,通常以二聚体形式存在。BH3中B以sp2杂化方式成键.CHHClClHHHHHH⑸二氯甲烷CH2Cl2⑹乙烷C2H6根据诱导效应规定::::烷烃分子中的CCCC––––CCCC和CCCC––––HHHH键不具有极性....2、以知σ键是分子之间的轴向电子分布,具有圆柱状对称,π键是pppp轨道的边缘交盖,π键与σ键的对称性有何不同?HHHHσ键具有对称轴,π键电子云分布在σ键平面的上下,π键具有对称面,就是σ键平面。3333、丙烷CHCHCHCH3333CHCHCHCH2222CHCHCHCH3333的分子按碳的四面体分布,试画出个原子的分布示意。4444、只有一种结合方式:2222个氢、1111个碳、1111个氧(HHHH2222COCOCOCO),试把分子的电子式画出来。上研途进组织找大牛微信公众号:yentocn官方微博:研途网5555、丙烯CHCHCHCH3333CHCHCHCH====CHCHCHCH2222中的碳,哪个是spspspsp3333杂化,哪个是spspspsp2222杂HOHC化?CH3-CH=CH2sp3sp2sp26666、试写试写出丁二烯分子中的键型:CH2=CH__CH=CH2σ-σ-σ-π-π-7777、试写出丙炔CHCHCHCH3333CCCC≡CHCHCHCH中碳的杂化方式。你能想象出spspspsp杂化的方式吗?sp3spspCH3CH=CH2根据杂化后形成的杂化轨道有着最佳的空间取向,彼此做到了最大程度的远离,可想像2个sp杂化轨道之间的夹角应互为1800,sp杂化的碳原子应为直线型构型。8888、二氧化碳的偶极矩为零,这是为什麽?如果CO2遇水后形成HCO3-或H2CO3,这时它们的偶极矩还能保持为零吗?碳酸分子为什麽是酸性的?化合物分子的偶极矩是分子中所有键偶极矩的矢量和,二氧化碳分O=C=O子中两个碳氧键的偶极矩大小相等、方向相反,故二氧化碳分子的偶极矩为零。C-OOO-CHOOOHHHH-2H+CHOOO-CHOOOHHHH碳酸和碳酸氢根的偶极矩不为零。碳酸根中的氧电负性比较大,具有容纳负电荷的能力。换言之:碳酸失去H+后形成的共轭碱碳酸根负离子比较稳定,所以碳酸分子显示酸性。9999、用δ++++////δ----符号对下列化合物的极性作出判断﹕(1)H3C__Br(2)H3C__NH2(3)H3C__Liδ-δ-δ-δ+δ+δ+δ-δ+(4)H2N__H(5)H3C__OH(6)H3C__MgBrδ-δ-δ+δ+10101010、HHHH2222NNNN----是一个比HOHOHOHO----更强的碱,对它们的共轭酸NHNHNHNH3333和HHHH2222O,哪个酸性更强?为什麽?上研途进组织找大牛微信公众号:yentocn官方微博:研...