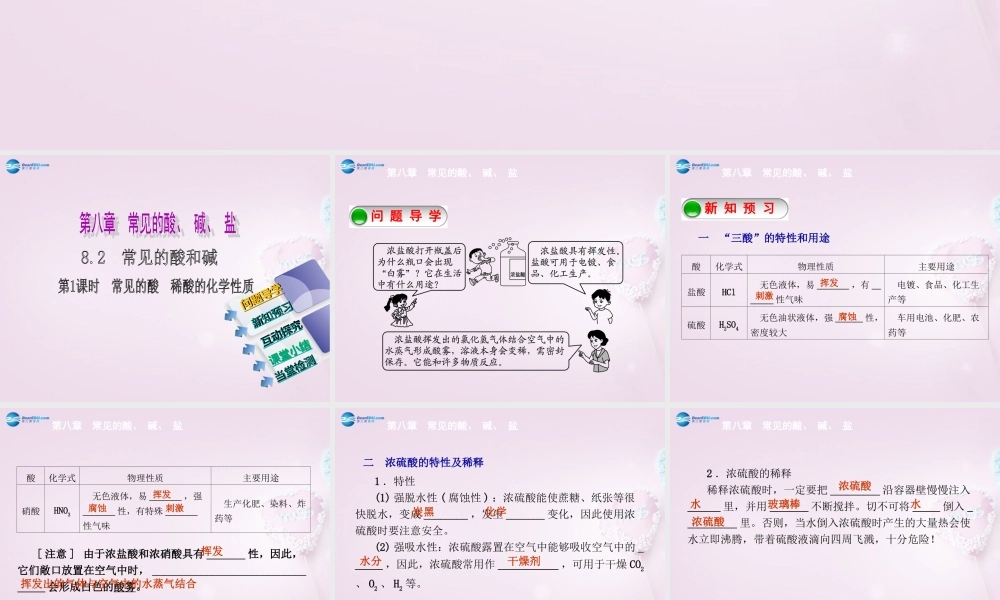
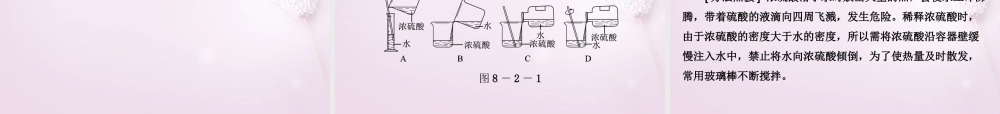
化学新知预习新知预习互动探究互动探究课堂小结课堂小结问题导学问题导学当堂检测当堂检测第八章常见的酸、碱、盐问题导学新知预习第八章常见的酸、碱、盐一“三酸”的特性和用途酸化学式物理性质主要用途盐酸HCl无色液体,易_______,有_______性气味电镀、食品、化工生产等硫酸H2SO4无色油状液体,强______性,密度较大车用电池、化肥、农药等挥发刺激腐蚀第八章常见的酸、碱、盐酸化学式物理性质主要用途硝酸HNO3无色液体,易_______,强_______性,有特殊_______性气味生产化肥、染料、炸药等挥发腐蚀刺激[注意]由于浓盐酸和浓硝酸具有_______性,因此,它们敞口放置在空气中时,_________________________________会形成白色的酸雾。挥发挥发出的气体与空气中的水蒸气结合1.特性(1)强脱水性(腐蚀性):浓硫酸能使蔗糖、纸张等很快脱水,变成________,发生_______变化,因此使用浓硫酸时要注意安全。(2)强吸水性:浓硫酸露置在空气中能够吸收空气中的______,因此,浓硫酸常用作___________,可用于干燥CO2、O2、H2等。第八章常见的酸、碱、盐二浓硫酸的特性及稀释炭黑化学水分干燥剂2.浓硫酸的稀释稀释浓硫酸时,一定要把_________沿容器壁慢慢注入______里,并用_______不断搅拌。切不可将_____倒入__________里。否则,当水倒入浓硫酸时产生的大量热会使水立即沸腾,带着硫酸液滴向四周飞溅,十分危险!第八章常见的酸、碱、盐浓硫酸水玻璃棒水浓硫酸第八章常见的酸、碱、盐三稀酸的化学性质通过学习总结出稀盐酸、稀硫酸等具有的四点相似的化学性质。化学性质符合反应的化学方程式(举一例)(1)酸和指示剂反应酸溶液能使紫色石蕊溶液变____;能使无色酚酞溶液_________(2)―→酸+活泼金属____+_____H2SO4+Fe===_______+_____盐氢气盐不变色FeSO4H2↑第八章常见的酸、碱、盐(3)―→酸+某些盐______+______HCl+AgNO3===_______+________2HCl+CaCO3===_______+______+_________(4)―→酸+金属氧化物_____+____6HCl+Fe2O3===_________+_______(根据此反应可推知盐酸的用途之一是__________)新酸新盐HNO3AgCl↓H2OCO2↑CaCl22FeCl33H2O金属除锈盐水[注意](1)酸与紫色石蕊溶液作用时,变红的是____________,而不是____。(2)由金属离子和酸根离子组成的化合物叫作盐,如硫酸亚铁、硝酸银等。(3)硝酸银是检验氯离子的试剂,可用硝酸银检验盐酸和其他在溶液中能产生Cl-的化合物。(4)用____来检验碳酸盐,向固体或溶液中加入____,...