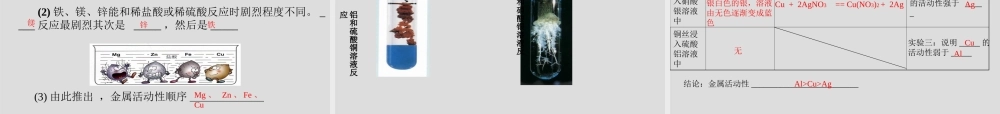
单元2金属的性质和金属材料一.金属材料的用途建筑,桥梁,器械,车辆,飞机,舰艇,生活用具等二、金属的物理性质二、金属的物理性质共性特性颜色状态密度熔点硬度导电、热性延展性大多数银白色、有金属光泽一般是固体密度较大熔点较高硬度较大良好的导电、导热性有延展性铜为紫红色、金为黄色汞(水银)为液体锇密度最大,锂最小钨的熔点最高、汞最低铬的硬度最大、汞最小银的导电性最好,铜第二金最好,银其次生活启示1.灯泡为什么用钨作灯丝?如果用锡制的话,可能会出现什么情况?2.铜铁为什么能作导线和炊具?银的导电性比铜好,为什么电线一般用铜制而不用银制?3.金银为什么能作手饰和货币?4.为什么有的铁制品如水龙头等要镀铬(Cr)?如果镀金怎么样?结论1、物质的用途决定于物质的性质,2、物质的用途决定于其价格、资源、美观性、便利性,3、物质的用途决定于其废料是否易于回收和对环境的影响等。1、地壳中含量最高的金属元素:2、人体中含量最高的金属元素:3、目前世界年产量最高的金属:4、导电、导热最好的金属:5、硬度最高的金属:6:熔点最高的金属:7:熔点最低的金属:8:密度最大的金属:9:密度最小的金属:资料:金属之最铝钙铁银铬钨汞锇(Os)锂镁条和铝片在常温下就能和空气中的氧气发生氧化反应。金属与氧气的反应4Al+3O2=2Al2O32Mg+O2=2MgO铜片和铁丝在高温时能与氧气反应2Cu+O2加热2CuO3Fe+2O2点燃Fe3O4金不能和氧气反应铁丝在氧气中燃烧高温炼金讨论1:从以下方程式你能得到哪些信息?(1)4Al+3O2=2Al2O3(2)2Cu+O2加热2CuO(3)2Mg+O2=2MgO(4)Au+O2→不反应(5)3Fe+2O2点燃Fe3O4综合上述信息可知:1.大多数金属都能与_______反应,反应剧烈程度________(相同,不相同)2.金属的活动性:说明_______较活泼,________次之,______很不活泼Au氧气不相同Al、MgFe、Cu金属和酸的反应反应物反应现象反应速度反应方程式稀盐酸或稀硫酸镁锌铁铜很快较快较慢不反应Mg+H2SO4==MgSO4+H2↑Mg+2HCl==MgCl2+H2↑Zn+H2SO4==ZnSO4+H2↑Zn+2HCl==ZnCl2+H2↑Fe+H2SO4==FeSO4+H2↑Fe+2HCl==FeCl2+H2↑剧烈反应,产生大量气泡剧烈反应,产生大量气泡反应缓慢,有气泡产生,溶液由无色变为浅绿色不反应讨论:(1)哪些金属能与盐酸、稀硫酸发生反应?反应后生成了什么气体?哪些金属不能与盐酸、稀硫酸发生反应?(3)由此推出,金属活动性顺序__________________铁、镁、锌能和稀盐酸或稀硫酸反应,反应后生成了氢气,铜不能和稀盐酸或稀硫酸...