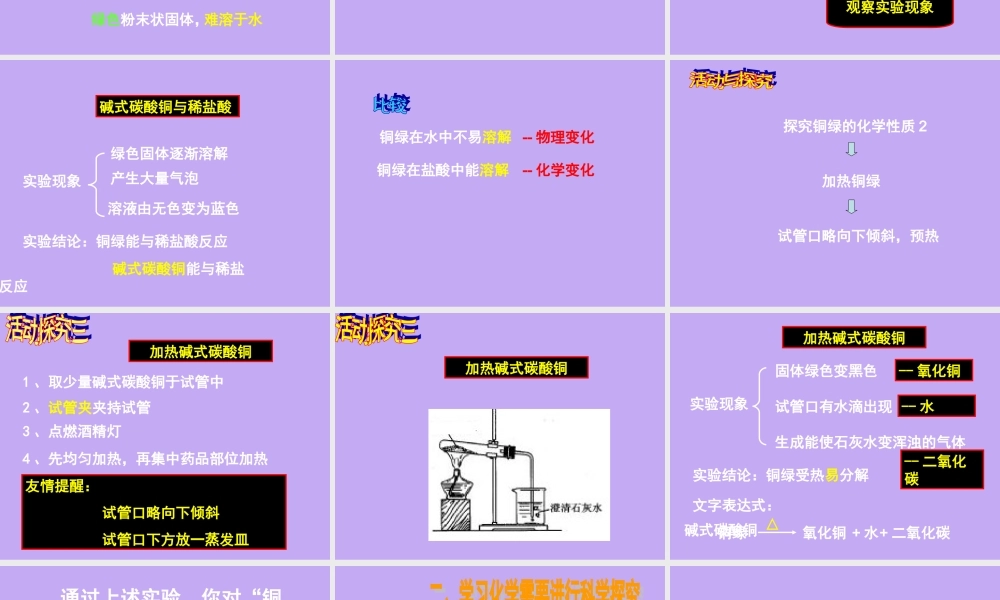
1、固体药品的取用2、液体药品的取用3、加热试管中固体的注意事项4、玻璃仪器洗涤干净的标志探究铜绿的性质铜绿的物理性质铜绿的化学性质1.铜绿(主要成分为碱式碳酸铜)2.主要物理性质:绿色粉末状固体碱式碳酸铜的溶解性1、取少量碱式碳酸铜于试管中2、向试管中倒入约2毫升蒸馏水观察溶解情况3、充分振荡,静置探究铜绿的性质铜绿的物理性质铜绿的化学性质1.铜绿(主要成分为碱式碳酸铜)2.主要物理性质:绿色粉末状固体,难溶于水探究铜绿的化学性质1铜绿与稀盐酸先固再取液碱式碳酸铜与稀盐酸1、取少量碱式碳酸铜于试管中2、向试管中倒入约2毫升稀盐酸3、充分振荡观察实验现象实验现象绿色固体逐渐溶解产生大量气泡溶液由无色变为蓝色实验结论:铜绿能与稀盐酸反应碱式碳酸铜能与稀盐反应碱式碳酸铜与稀盐酸铜绿在水中不易溶解铜绿在盐酸中能溶解--物理变化--化学变化探究铜绿的化学性质2加热铜绿试管口略向下倾斜,预热加热碱式碳酸铜1、取少量碱式碳酸铜于试管中2、试管夹夹持试管3、点燃酒精灯4、先均匀加热,再集中药品部位加热友情提醒:试管口略向下倾斜试管口下方放一蒸发皿加热碱式碳酸铜实验现象固体绿色变黑色试管口有水滴出现生成能使石灰水变浑浊的气体实验结论:铜绿受热易分解--氧化铜--水--二氧化碳铜绿碱式碳酸铜+水氧化铜+二氧化碳△加热碱式碳酸铜文字表达式:通过上述实验,你对“铜绿”有什么认识?1.物理性质:绿色粉末状固体,不易溶于水.2.化学性质:(1)能与盐酸作用,生成氯化铜、水和二氧化碳(2)受热能分解,生成氧化铜、水和二氧化碳科学探究的一般步骤:提出问题→猜想与假设→设计实验→进行实验→收集证据→解释结论→反思与评价→表达与交流铁、铜、铝是生活中常见金属。镁也是一种重要的金属,它可能具有哪些性质和用途?如果想知道镁能否导电以及能否燃烧,应该怎样实验?阅读课本P19活动与探究的5项进行实验探究1、颜色状态2、是否容易被折断3、是否可以导电4、在空气中点燃的现象5、在食醋中的变化根据你对铁、铜、铝的了解,猜想是镁可能具有哪些性质?【猜想与假设】:(1)镁是一种银白色的固体,硬度不大(2)镁条能够导电(3)镁能与酸发生反应;(4)镁能与空气中成分(氧气)发生作用;【实验设计】:(1)取一段镁条观察外观,看看是否容易扭曲;(2)将镁条连接电路,观察灯泡是否发亮;(3)经过砂纸表面打磨后,投入到食醋中,观察现象;(4)经过砂纸表面的打磨后,用酒精灯加热,观察是否能够燃烧;...