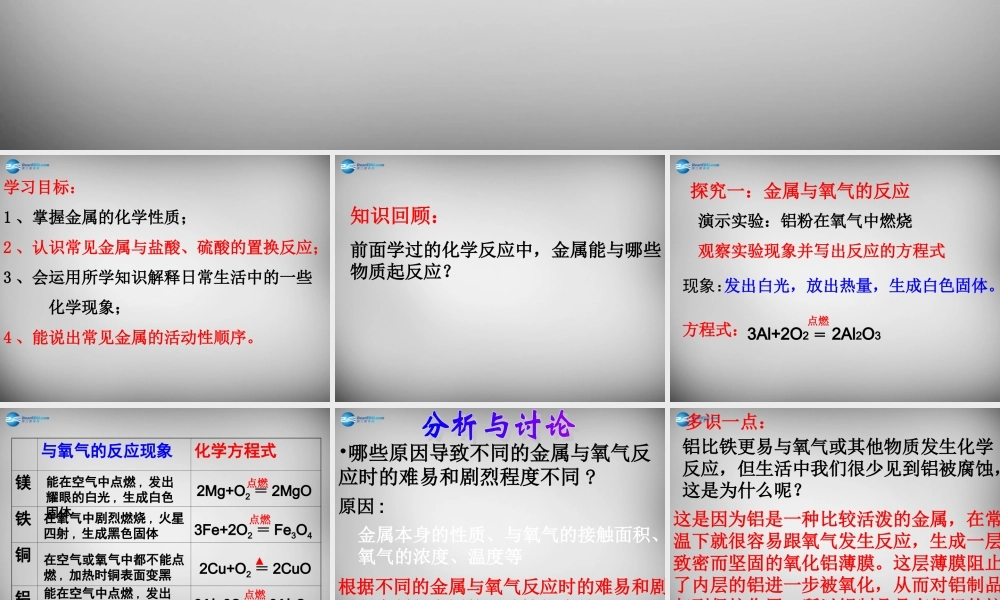
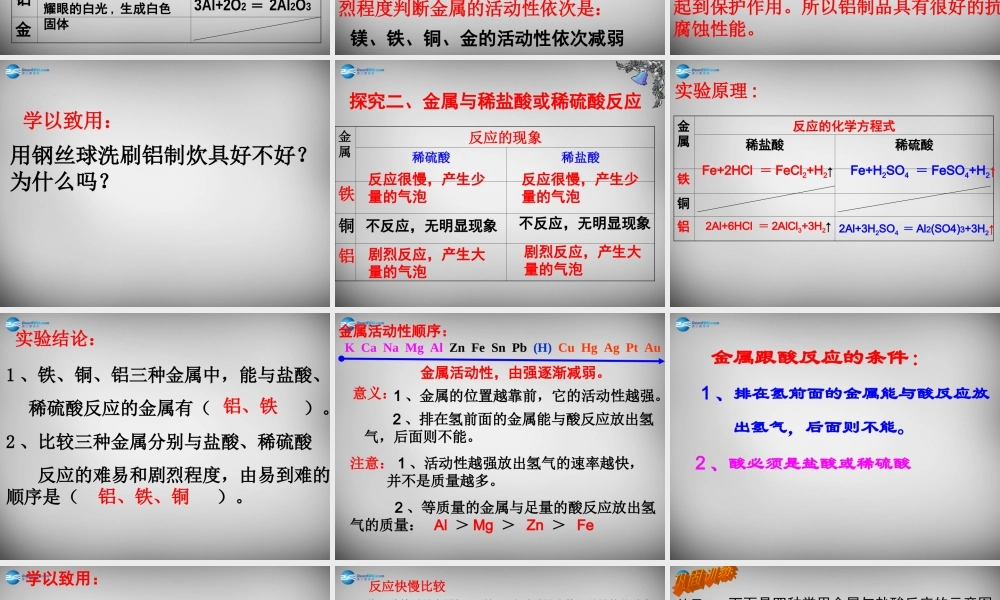
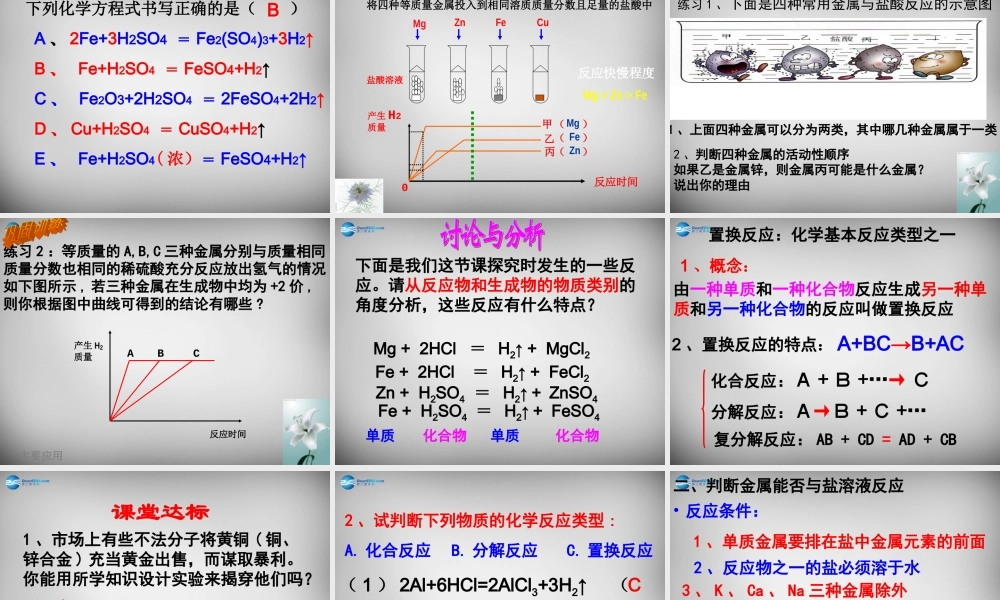
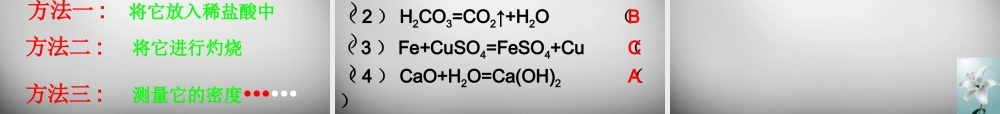
第二节金属的化学性质学习目标:1、掌握金属的化学性质;2、认识常见金属与盐酸、硫酸的置换反应;3、会运用所学知识解释日常生活中的一些化学现象;4、能说出常见金属的活动性顺序。知识回顾:前面学过的化学反应中,金属能与哪些物质起反应?探究一:金属与氧气的反应演示实验:铝粉在氧气中燃烧观察实验现象并写出反应的方程式现象:发出白光,放出热量,生成白色固体。方程式:3Al+2O2=2Al2O3点燃与氧气的反应现象化学方程式镁铁铜铝金能在空气中点燃,发出耀眼的白光,生成白色固体在氧气中剧烈燃烧,火星四射,生成黑色固体在空气或氧气中都不能点燃,加热时铜表面变黑2Mg+O2=2MgO点燃3Fe+2O2=Fe3O4点燃2Cu+O2=2CuO▲能在空气中点燃,发出耀眼的白光,生成白色固体点燃3Al+2O2=2Al2O3•哪些原因导致不同的金属与氧气反应时的难易和剧烈程度不同?原因:金属本身的性质、与氧气的接触面积、氧气的浓度、温度等镁、铁、铜、金的活动性依次减弱根据不同的金属与氧气反应时的难易和剧烈程度判断金属的活动性依次是:多识一点:铝比铁更易与氧气或其他物质发生化学反应,但生活中我们很少见到铝被腐蚀,这是为什么呢?这是因为铝是一种比较活泼的金属,在常温下就很容易跟氧气发生反应,生成一层致密而坚固的氧化铝薄膜。这层薄膜阻止了内层的铝进一步被氧化,从而对铝制品起到保护作用。所以铝制品具有很好的抗腐蚀性能。学以致用:用钢丝球洗刷铝制炊具好不好?为什么吗?金属反应的现象稀硫酸稀盐酸铁铜铝探究二、金属与稀盐酸或稀硫酸反应剧烈反应,产生大量的气泡反应很慢,产生少量的气泡不反应,无明显现象不反应,无明显现象剧烈反应,产生大量的气泡反应很慢,产生少量的气泡实验原理:金属反应的化学方程式稀盐酸稀硫酸铁铜铝2Al+6HCl=2AlCl3+3H2↑Fe+2HCl=FeCl2+H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑Fe+H2SO4=FeSO4+H2↑实验结论:1、铁、铜、铝三种金属中,能与盐酸、稀硫酸反应的金属有()。2、比较三种金属分别与盐酸、稀硫酸反应的难易和剧烈程度,由易到难的顺序是()。铝、铁铝、铁、铜金属活动性顺序:KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu金属活动性,由强逐渐减弱。1、金属的位置越靠前,它的活动性越强。2、排在氢前面的金属能与酸反应放出氢气,后面则不能。注意:1、活动性越强放出氢气的速率越快,并不是质量越多。2、等质量的金属与足量的酸反应放出氢气的质量:Al>Mg>Zn>Fe意义:金属跟酸反应的条件:1、排在氢前面的金属能与...