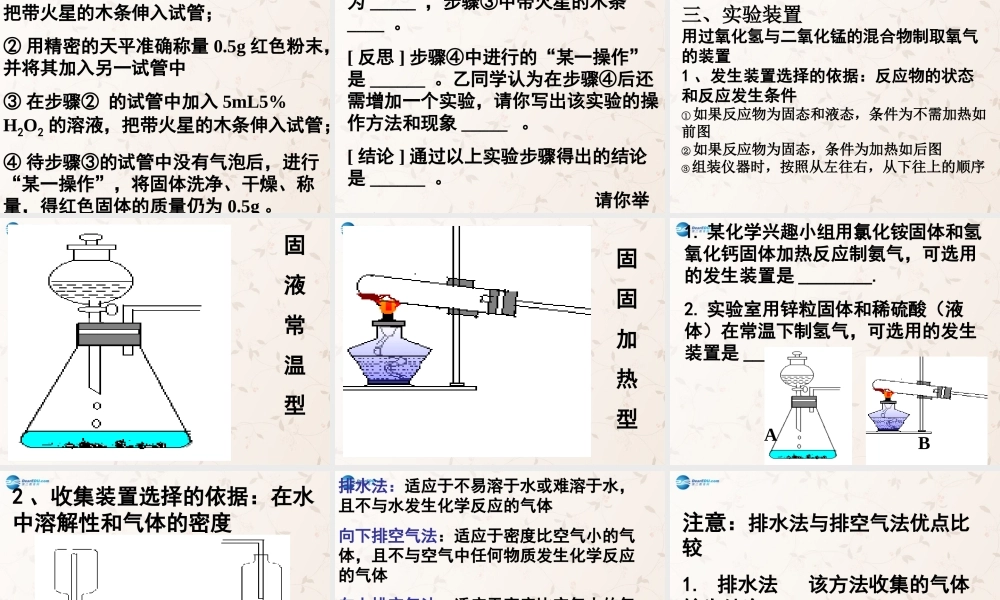
第三节氧气的实验室制法复习:到目前为止,你知道哪些方法能得到氧气?能否用这些方法在实验室中制得氧气?工业制氧气:分离液态空气法。通电分解水:水氢气+氧气通电H2OH2O2颜色气味状态标准状况的密度与空气密度比较(1.293g/L)熔点沸点是否易溶于水-218℃-183℃氧气的物理性质:(在通常状况下)无色无味气体略大不易溶1.429g/L氧气液态氧固态氧101kPa,-183℃101kPa,-218℃(无色)(淡蓝色)(淡蓝色)氧气贮存在天蓝色钢瓶中下列哪些物质可能产生氧气?1、食盐(主要成分为NaCl)2、过氧化氢(H2O2)3、氧化汞(HgO)4、高锰酸钾(KMnO4)5、氯酸钾(KClO3)6、甲烷(CH4)7、水(H2O)(1)KMnO4高锰酸钾是一种紫黑色的固体,在加热时能产生氧气,成本较高。(2)KClO3氯酸钾是一种白色固体,加热时能产生氧气,如果混有可燃性杂质可能会发生爆炸。(3)H2O2过氧化氢又称双氧水,是一种无色的液体,常温下就可生成氧气和水,反应速度适中,价格低廉。(4)HgO氧化汞是一种红色粉末,加热时能产生氧气,同时产生有毒的物质汞。(5)H2O水在通电的条件下能产生氧气,成本高,反应速度太慢。资料介绍实验室制取气体要求:装置简单,操作方便,条件不能太高,无安全隐患,符合绿色化学观点一、氧气的实验室制法(一)原理在二氧化锰的催化作用下,过氧化氢迅速分解产生氧气和水。表达式:双氧水二氧化锰水+氧气1.药品:二氧化锰、双氧水2.条件:不需加热3.反应类型:分解反应二、催化剂P88实验探究讨论:1.比较上述几个实验,说明过氧化氢分解出氧气需要什么条件?在二氧化锰存在条件下2、若在实验前准确称出MnO2质量,实验后将MnO2回收、干燥、再称量,会发现它质量不变,你对MnO2所起的作用有什么看法?MnO2能促使H2O2分解,但它质量不变说明它本身不分解3、将分离出来的MnO2再放入A试管中和MnO2在B试管中起相同作用,这又说明什么?MnO2在化学反应前后化学性质没有改变小结:凡能改变其它物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂特点:“一变两不变”催化剂在生产、生活和科研中有重要作用。实验室用过氧化氢分解制氧气,常用MnO2作催化剂。[提出问题]其他物质能作分解的催化剂吗?[猜想]甲同学认为CuO或Fe2O3可以代替MnO2,因为按物质的分类MnO2、CuO、Fe2O3都属于__。[设计实验]甲同学按下面步骤进行①在试管中加入5mL5%H2O2的溶液,把带火星的木条伸入试管;②用精密的天平准确称量0.5g红色粉末,...