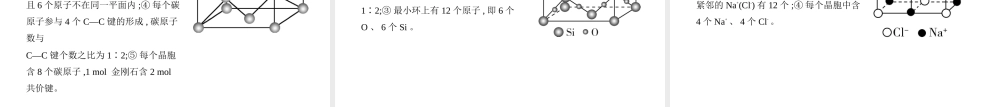
高考化学新高考专用专题八化学键分子和晶体的结构与性质考点一化学键分子间作用力基础篇一、化学键1.共价键1)共价键类型注意:共价键成键规律:共价单键是σ键;1个共价双键中有1个σ键、1个π键;1个共价三键中有1个σ键、2个π键。3)配位键:一种特殊的共价键,由一方提供孤电子对,另一方接受孤电子对形成“电子对给予—接受”键。配位键可表示为A→B,其中A是能够提供孤电子对的原子或离子(称为配体或配位体),B是具有能够接受孤电子对的空轨道的原子或离子。配合物:通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。如:2)共价键的键参数及对分子性质的影响2.离子键、金属键1)离子键:阴、阳离子之间的静电作用。成键条件为成键原子所属元素电负性差值较大。2)金属键:金属阳离子和自由电子之间的一种电性作用,存在于同种金属元素原子之间或不同种金属元素原子之间(合金)。3.物质的表示方法电子式的书写方法如下:2)结构式:电子式中共用电子对用短线“—”代替,省略未成键电子,如HCl→H—Cl,NH3→。二、分子间作用力1.范德华力一般来说,组成和结构相似的物质,相对分子质量越大,范德华力越强,物质的熔、沸点越高;相对分子质量接近时,分子极性越强,范德华力越强。2.氢键1)概念:氢键是由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力。2)表示方法:X—H…Y—,X、Y分别可为N、O、F,“—”表示共价键,“…”表示形成的氢键。3)氢键不属于化学键。氢键影响物质的熔、沸点,溶解性等。1.价层电子对互斥(VSEPR)模型1)理论要点①价层电子对在空间上彼此相距最远时,排斥力最小,体系的能量最低。②孤电子对的排斥力较大,孤电子对越多,排斥力越强,键角越小。2)中心原子价层电子对数(n)计算方法n=σ键电子对数+中心原子上的孤电子对数①计算法:中心原子上的孤电子对数=(a-xb)。对于中性分子,式中a为中心原子的价电子数;对于阳离子,a为中心原子的价电子数减去离子所带的电荷数;对于阴离子,a为中心原子的价电子数加上离子所带的电荷数。x为与中心原子结合的原子数。b为与中心原子结合的原子最多能接受的电子数考点二分子结构与性质σ键电子对数由化学式确定,σ键电子对数=与中心原子结合的原子个数。②电子式或结构式法:写出电子式或结构式,观察σ键电子对数和中心原子上的孤电子对数,两者相加即可。2.杂化轨道理论1)理论要点:中心原子上若干不同类型(主要...