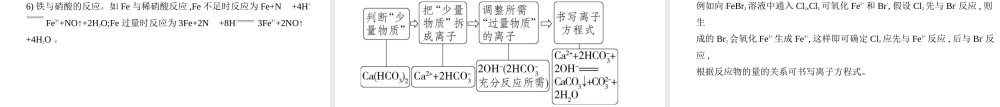
高考化学新高考专用专题三离子反应考点一离子反应基础篇一、电解质的分类与电离1.电解质的分类注意:电解质和非电解质均属于化合物。单质和混合物既不是电解质也不是非电解质,如Cu、NaCl溶液等。2.电离方程式的书写1)强电解质的电离用“”连接,弱电解质的电离用“”连接。2)多元弱酸分步电离,以第一步电离为主,如碳酸存在电离:H2CO3HC+H+(主),HCH++C(次)。多元弱碱的电离用一步电离表示,如Fe(OH)3Fe3++3OH-。3)在水溶液中强酸的酸式盐中酸式酸根离子完全电离,弱酸的酸式盐中酸式酸根离子不完全电离。例如:NaHSO4:NaHSO4Na++H++SNaHCO3:NaHCO3Na++HCHCH++C说明:在熔融状态时:NaHSO4Na++HS。3.电解质的导电1)导电的物质(含有自由移动的带电荷的粒子):金属单质、少数非金属单质、电解质水溶液或熔融电解质。2)电解质水溶液或熔融电解质能导电,是因为其中有自由移动的离子。3)在水溶液中或熔融状态下能够导电的化合物叫作电解质。“导电的化合物”是指化合物自身能发生电离而导电,像NH3、CO2、SO2、SO3等的水溶液虽然能够导电,但不是自身发生电离而导电,所以它们不是电解质。二、离子反应1.概念:有离子参加的反应。2.离子反应发生的条件1)在水溶液中发生复分解反应的条件①生成沉淀,如BaSO4、CaCO3、CuS等;②生成气体,如CO2、NH3等;③生成弱电解质,如弱酸、弱碱、水等。2)离子之间发生氧化还原反应的条件强氧化性离子和强还原性离子相遇发生反应而使离子浓度发生变化。例如FeCl3溶液中加入KI溶液,FeCl2溶液中通入Cl2的离子方程式分别为2Fe3++2I-2Fe2++I2,2Fe2++Cl22Fe3++2Cl-。1.离子方程式的书写步骤以CaCO3和盐酸的反应为例考点二离子方程式2.离子方程式书写的关键综合离子共存与离子推断一、离子能否大量共存的判断要点1.溶液颜色:Cu2+(蓝色)、Fe3+(黄色)、Fe2+(浅绿色)、Mn(紫红色)等。2.溶液的酸碱性1)酸性溶液:①使甲基橙变红;②常温下>1、<1×10-7mol/L、>1×10-7mol/L等。2)碱性溶液:①使酚酞变红;②常温下<1、>1×10-7mol/L、<1×10-7mol/L等。综合篇3.反应类型1)复分解反应:如Ba2+与S,N与OH-,H+与CH3COO-等。2)氧化还原反应:如Fe3+与I-、S2-,N(H+)与F等。3)相互促进的水解反应:如Al3+与C、HC或Al等。4)配合反应:如Fe3+与SCN-等。3)酸性或碱性溶液:①常温下由水电离出的c(H+)<1×10-7mol/L的溶液;②与Al反应能放出H2的溶液等。注意:与Al反应放出H2的溶液,若是酸性溶液,则不含有N。二、离子推断的“四原则”例(2020江苏单科,4,2分)常温下,下列各...