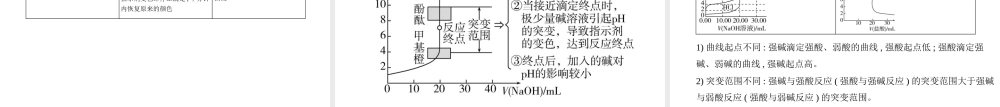
高考化学新高考专用专题十二弱电解质的电离平衡和溶液的酸碱性考点一弱电解质的电离平衡基础篇1.强电解质和弱电解质2.弱电解质的电离平衡1)建立与特征2)外界条件对电离平衡的影响①温度:升温,电离平衡右移,电离程度增大。②浓度:稀释溶液,电离平衡右移,电离程度增大。③同离子效应:加入与弱电解质具有某种相同离子的强电解质,电离平衡左移,电离程度减小。④加入能与弱电解质电离出的离子反应的物质:电离平衡右移,电离程度增大。如0.1mol·L-1的醋酸溶液[CH3COOHH++CH3COO-(ΔH>0)],若改变条件后,有如下变化:注意:电离平衡右移,电离程度不一定增大。例如增大弱电解质的浓度,电离平衡向右移动,但电离程度减小。3)电解质溶液的导电能力:取决于自由移动离子的浓度和离子所带电荷数,自由移动离子的浓度越大、离子所带电荷数越多,导电能力越强。注意:电解质溶液的导电能力与电解质的强弱无必然关系,强电解质在水中的导电能力不一定强,如BaSO4。3.电离平衡常数1)表达式:对一元弱酸HA,HAH++A-,Ka=。2)特点:多元弱酸分步电离,各级电离常数的大小关系是≫≫……故其酸性主要取决于第一步电离。3)影响因素①内因:弱电解质本身的性质。②外因:只与温度有关,温度升高,Ka增大。应用举例判断弱酸酸性(或弱碱碱性)的相对强弱Ka(HF)>Ka(HClO),则同浓度溶液的酸性:HF>HClO判断酸与盐反应是否能发生(强酸制弱酸)(H2CO3)>Ka(HClO)>(H2CO3),则NaClO+CO2+H2ONaHCO3+HClO判断酸式酸根离子的电离和水解程度的相对大小25℃时,H2CO3的=4.5×10-7、=4.7×10-11,HC的水解常数:Kh==≈2.2×10-8>,故HC的水解程度大于其电离程度4)应用一、溶液的酸碱性考点二溶液的酸碱性酸碱中和滴定1.水的电离1)水的电离平衡:H2OH++OH-。2)影响水的电离平衡的因素有①温度:温度升高,促进水的电离;②酸、碱:加酸或碱会抑制水的电离;③能水解的盐:加能水解的盐,促进水的电离。条件变化电离平衡溶液中c(H+)溶液中c(OH-)pH溶液的酸碱性KW升高温度右移增大增大减小中性增大加酸左移增大减小减小酸性不变加碱左移减小增大增大碱性不变Na2CO3右移减小增大增大碱性不变NH4Cl右移增大减小减小酸性不变加入Na右移减小增大增大碱性不变3)水的离子积:KW=c(H+)·c(OH-)。一定温度时,KW为常数,KW只与温度有关。水的电离是吸热过程,温度越高,KW越大。常温下,KW=1×10-14。注意:KW表达式中的H+和OH-不一定都是由水电离出来的,指的是溶液中的c(H+)和c(OH-)。2.溶液的酸碱性和pH1)溶液的酸碱性pHc(H+)/(mol·L-1)c(H...