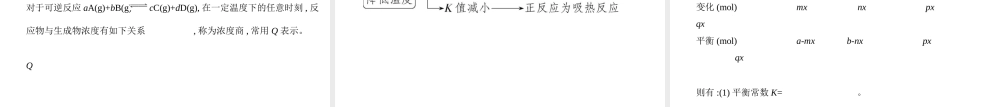
高考化学新高考专用专题十一化学反应速率和化学平衡考点一化学反应速率基础篇1.化学反应速率1)表示方法:通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。表达式为v=,单位为mol·L-1·s-1或mol·L-1·min-1。注意:不能用固体或纯液体表示化学反应速率,因为固体或纯液体的浓度视为常数。2)与化学计量数的关系:对于反应mA(g)+nB(g)pC(g)+qD(g),用不同物质表示的反应速率的数值不同,但意义相同。单位相同时,各物质化学反应速率的数值之比等于方程式中各物质的化学计量数之比。2.影响化学反应速率的因素1)内因(主要因素)——反应物本身的性质。2)外因①浓度:增大反应物浓度,反应速率增大,反之减小。②压强:对于有气体参加的反应,增大压强,反应速率增大,反之减小。解释:增大反应物浓度或增大压强,单位体积内活化分子数增多,单位时间内有效碰撞次数增多,化学反应速率增大。注意:充入无关气体(不参与反应的气体)的影响恒温恒容时:充入无关气体→总压强增大,各反应物浓度不变→反应速率不变。恒温恒压时:充入无关气体→总体积增大,各反应物浓度减小→反应速率减小。③温度:升高温度,反应速率增大,反之减小,与反应吸热还是放热无关。④催化剂:使用催化剂,一般可加快反应速率。解释:升温、使用催化剂时,体系中活化分子百分数增加,有效碰撞次数增加,化学反应速率增大。⑤其他因素:如反应物的接触面积增大,反应速率增大;构成原电池,反应速率增大。考点二化学平衡1.化学平衡研究的对象——可逆反应2.化学平衡状态1)特征以反应mA(g)+nB(g)pC(g)+qD(g)为例:2)判断——“正、逆相等,变量不变”类别可能的情况举例是否达到平衡混合物中各成分的含量各物质的物质的量或各物质的物质的量分数一定平衡各物质的质量或各物质的质量分数一定平衡各气体的体积或体积分数一定平衡总压强、总体积、总物质的量一定不一定平衡正、逆反应速率的关系在单位时间内消耗了mmolA的同时生成了mmolA,即v正=v逆平衡在单位时间内消耗了nmolB的同时消耗了pmolC平衡v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q不一定平衡在单位时间内生成了nmolB,同时消耗了qmolD不一定平衡压强恒容时压强不再变化,当m+n≠p+q时平衡恒容时压强不再变化,当m+n=p+q时不一定平衡混合气体的平均相对分子质量一定,当m+n≠p+q时平衡一定,当m+n=p+q时不一定平衡气体的密度恒容时气体密度一定不一定平衡颜色反应体系的颜色不变,即有色物质的浓度不变平衡3.化学平衡移动1)化学平衡移动的过程2)化学平衡移动方向与化...