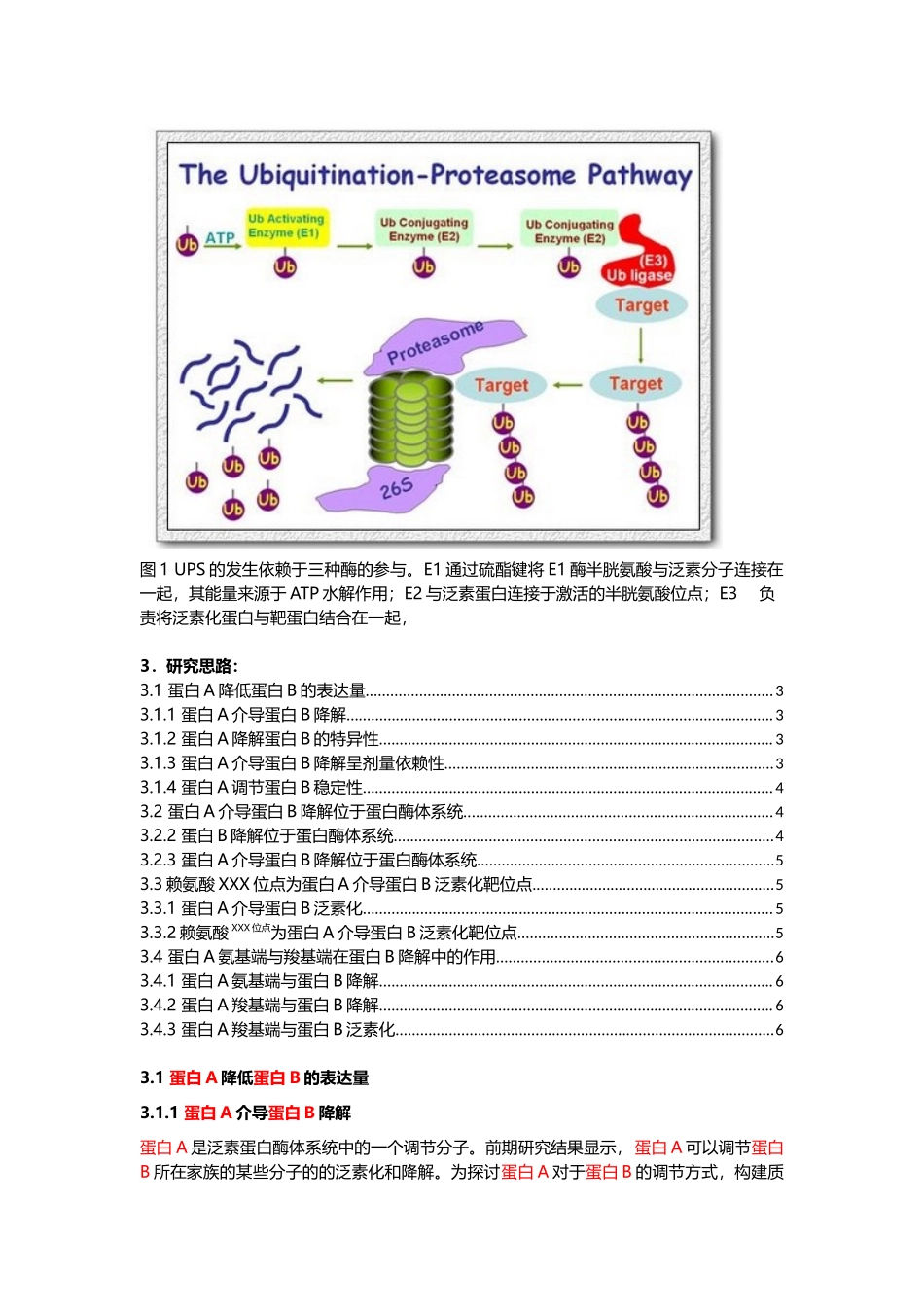
分子机制研究套路(二)蛋白翻译后修饰-泛素化课题:蛋白A调节蛋白B泛素化和降解的研究1.概念介绍:大多数蛋白均需进行翻译后修饰来扩增蛋白质组的数量,调节蛋白质的稳定性、分布和功能。翻译后修饰包括磷酸化、泛素化、亚硝基化、氧化等等。泛素化是在蛋白质翻译后,通过将泛素分子结合到靶蛋白上,形成多聚泛素链,带有多聚泛素链的靶蛋白可被26S蛋白酶体识别、降解。泛素是76个氨基酸的多肽片段,包含7个赖氨酸残基,允许同时发生聚泛素化反应。在赖氨酸-48聚泛素化会导致其通过28S蛋白酶体降解。然而赖氨酸-63可以改变细胞的功能,包括运输和DNA修复。可见,单一的泛素化会依据其作用位点的不同而产生不同的结果。它和泛素激活酶(E1)、泛素结合酶(E2)、泛素连接酶(E3)和蛋白酶体组成了泛素-蛋白酶体系统(Ubiquitin-ProteasomeSystem,UPS)。UPS是细胞内非溶酶体途径蛋白质降解通路,不仅降解变性、异常或起短暂作用的蛋白质,而且能降解转录因子、内膜蛋白和细胞周期蛋白等天然蛋白,对于维持蛋白质稳定状态、调节细胞程序性死亡和控制细胞周期等过程有重要的作用。UPS还可作用于转录因子及体内的某些信号传导通路,并参与细胞凋亡、主要组织相容性复合体抗原递呈、细胞周期以及细胞内信号传导等多个细胞生理活动,对维持细胞正常生理功能具有重要意义。2.示意图:图1UPS的发生依赖于三种酶的参与。E1通过硫酯键将E1酶半胱氨酸与泛素分子连接在一起,其能量来源于ATP水解作用;E2与泛素蛋白连接于激活的半胱氨酸位点;E3负责将泛素化蛋白与靶蛋白结合在一起,3.研究思路:3.1蛋白A降低蛋白B的表达量...................................................................................................33.1.1蛋白A介导蛋白B降解........................................................................................................33.1.2蛋白A降解蛋白B的特异性................................................................................................33.1.3蛋白A介导蛋白B降解呈剂量依赖性................................................................................33.1.4蛋白A调节蛋白B稳定性....................................................................................................43.2蛋白A介导蛋白B降解位于蛋白酶体系统........................................................