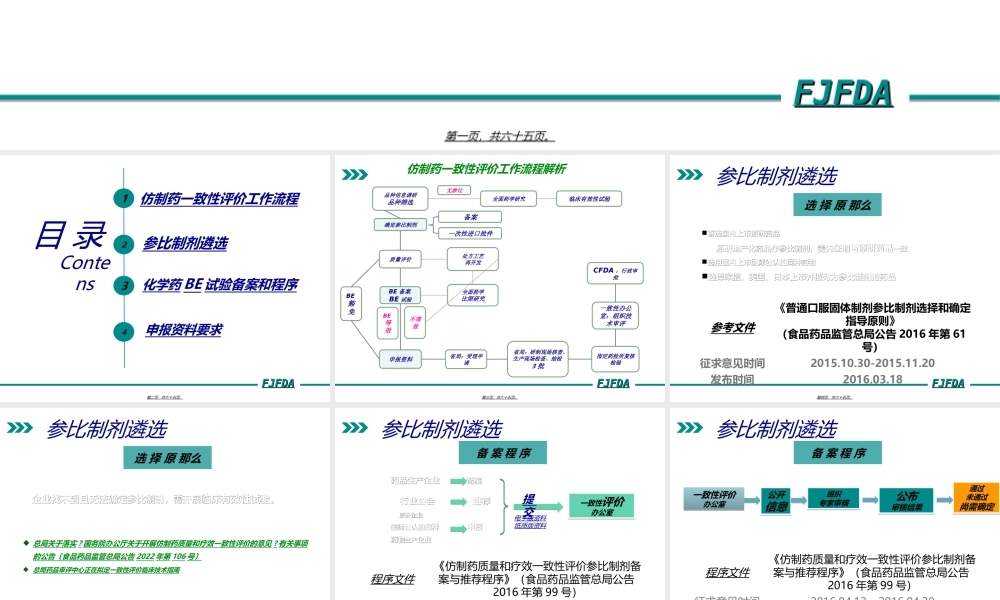
FZYFJFDAFJFDAFJFDAFJFDA仿制药质量和疗效一致性评价参比制剂与BE备案20222022年年66月月2424日日第一页,共六十五页。FZYFJFDAFJFDAFJFDAFJFDA目录Contens12参比制剂遴选化学药BE试验备案和程序仿制药一致性评价工作流程申报资料要求34第二页,共六十五页。FZYFJFDAFJFDAFJFDAFJFDA全面药学研究指定药检所复核检验全面药学比照研究省局:受理申请临床有效性试验无参比确定参比制剂备案省局:研制现场核查、生产现场检查、抽检3批一致性办公室:组织技术审评CFDA:行政审批处方工艺再开发BE豁免质量评价BE备案BE试验BE等效仿制药一致性评价工作流程解析一次性进口批件品种信息调研品种筛选申报资料不等效第三页,共六十五页。FZYFJFDAFJFDAFJFDAFJFDA参比制剂遴选选择原那么首选国内上市原研药品首选国内上市原研药品原研原研地产化药品作参比制剂,地产化药品作参比制剂,需先证明需先证明与原研药品与原研药品一致一致选用国内上市国际公认的同种药物选用国内上市国际公认的同种药物选择欧盟、美国、日本上市并被列为参比制剂的药品选择欧盟、美国、日本上市并被列为参比制剂的药品参考文件《普通口服固体制剂参比制剂选择和确定指导原则》(食品药品监管总局公告2016年第61号)征求意见时间2015.10.30-2015.11.20发布时间2016.03.18第四页,共六十五页。FZYFJFDAFJFDAFJFDAFJFDA参比制剂遴选企业找不到且无法确定参比企业找不到且无法确定参比制剂,需开展制剂,需开展临床有效性试验临床有效性试验。。总局关于落实?国务院办公厅关于开展仿制药质量和疗效一致性评价的意见?有关事项的公告〔食品药品监管总局公告2022年第106号〕总局药品审评中心正在拟定一致性评价临床技术指南选择原那么第五页,共六十五页。FZYFJFDAFJFDAFJFDAFJFDA参比制剂遴选药品生产企业药品生产企业备案备案行业协会推荐行业协会推荐原研企业原研企业国际公认的国际公认的同种同种申报申报药物药物生产生产企业企业一致性评价办公室一致性评价办公室程序文件《仿制药质量和疗效一致性评价参比制剂备案与推荐程序》(食品药品监管总局公告2016年第99号)征求意见时间2016.04.12—2016.04.30发布时间2016.05.19备案程序电子版资料纸质版资料提交第六页,共六十五页。FZYFJFDAFJFDAFJFDAFJFDA参比制剂遴选一致性评价办公室一致性评价办公室程序文件《仿制药质量和疗效一致性评价参比制剂备案与推荐程序》(食品药品监管总局公告2016年第99号)征求意见时间2016.0...