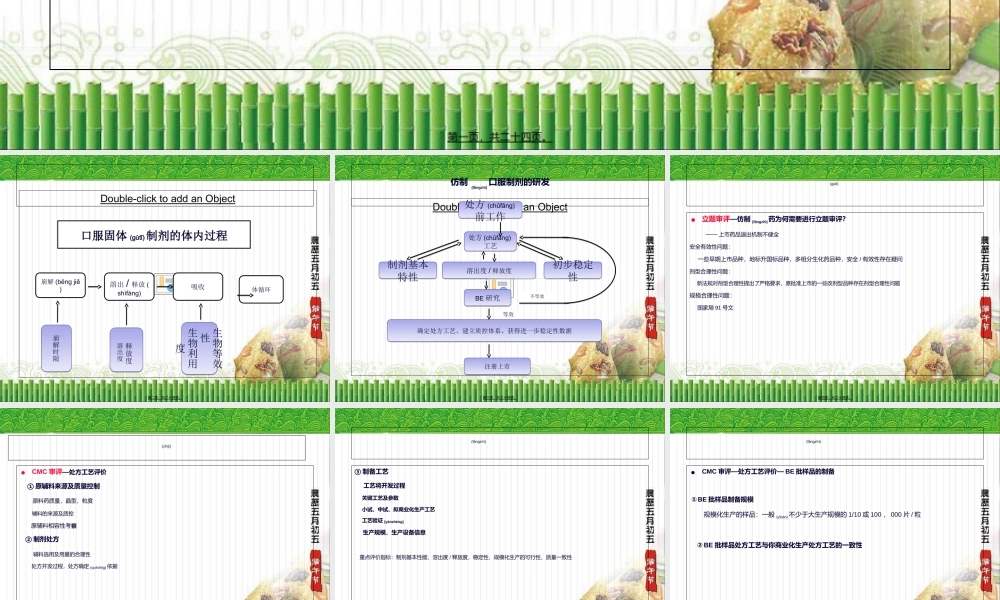
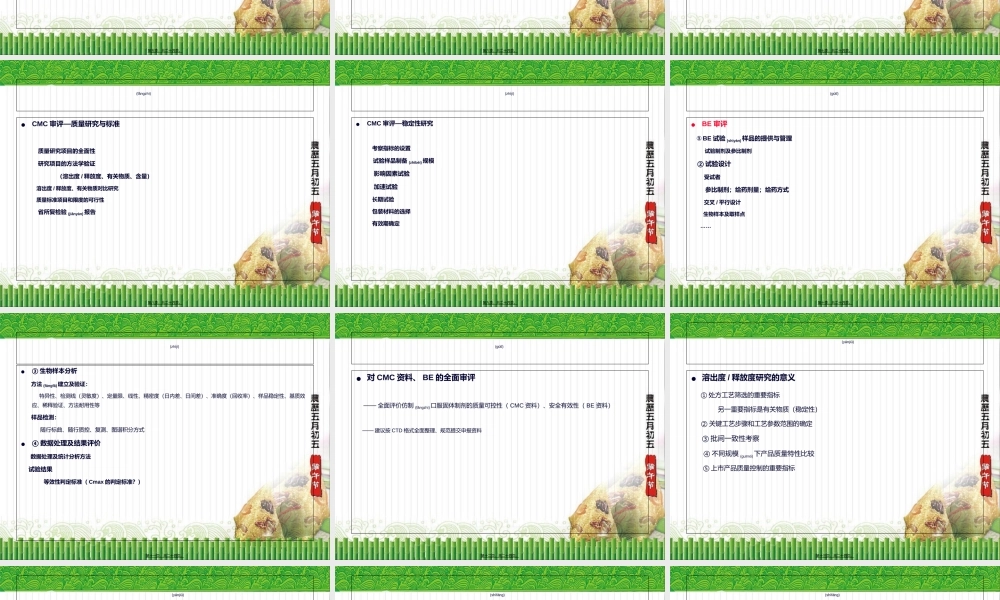
(tígāng)•口服固体制剂(zhìjì)体内过程特点•口服固体制剂的研发•仿制口服固体制剂审评策略•溶出度/释放度研究与评价•BE试验与评价第一页,共二十四页。Double-clicktoaddanObject口服固体(gùtǐ)制剂的体内过程崩解(bēnjiěɡ)溶出/释放(shìfàng)吸收体循环崩解时限崩解时限释放度溶出度释放度溶出度生物等效性生物利用度生物等效性生物利用度第二页,共二十四页。仿制(fǎngzhì)口服制剂的研发Double-clicktoaddanObject处方(chǔfāng)前工作处方(chǔfāng)前工作处方(chǔfāng)工艺处方(chǔfāng)工艺溶出度/释放度溶出度/释放度BE研究BE研究确定处方工艺、建立质控体系、获得进一步稳定性数据确定处方工艺、建立质控体系、获得进一步稳定性数据注册上市注册上市制剂基本特性制剂基本特性初步稳定性初步稳定性等效不等效第三页,共二十四页。(gùtǐ)•立题审评—仿制(fǎngzhì)药为何需要进行立题审评?——上市药品退出机制不健全安全有效性问题:一些早期上市品种,地标升国标品种,多组分生化药品种,安全/有效性存在疑问剂型合理性问题:新法规对剂型合理性提出了严格要求,原批准上市的一些改剂型品种存在剂型合理性问题规格合理性问题:国家局91号文第四页,共二十四页。(zhìjì)•CMC审评—处方工艺评价①原辅料来源及质量控制原料药质量,晶型,粒度辅料的来源及质控原辅料相容性考察②制剂处方辅料选用及用量的合理性处方开发过程,处方确定(quèdìng)依据第五页,共二十四页。(fǎngzhì)③制备工艺工艺将开发过程关键工艺及参数小试、中试、拟商业化生产工艺工艺验证(yànzhèng)生产规模,生产设备信息重点评价指标:制剂基本性能、溶出度/释放度,稳定性,规模化生产的可行性,质量一致性第六页,共二十四页。(fǎngzhì)•CMC审评—处方工艺评价—BE批样品的制备①BE批样品制备规模规模化生产的样品:一般(yībān)不少于大生产规模的1/10或100,000片/粒②BE批样品处方工艺与你商业化生产处方工艺的一致性第七页,共二十四页。(fǎngzhì)•CMC审评—质量研究与标准质量研究项目的全面性研究项目的方法学验证(溶出度/释放度、有关物质、含量)溶出度/释放度、有关物质对比研究质量标准项目和限度的可行性省所复检验(jiǎnyàn)报告第八页,共二十四页。(zhìjì)•CMC审评—稳定性研究考察指标的设置试验样品制备(zhìbèi)规模影响因素试验加速试验长期试验包装材料的选择有效期确定第九页,共二十四页。...