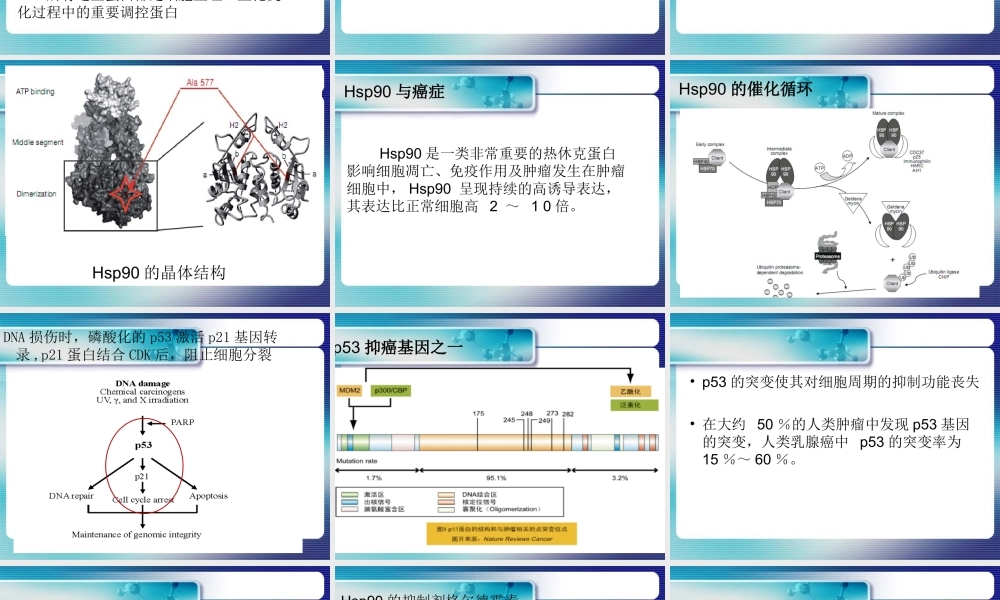
热休克蛋白-Hsp90主讲人:李治国李云萍李彩霞组员:李乐李慧娟李燕星刘超刘大志热休克蛋白•热休克蛋白(HeatShockProtein,Hsp)是1962年由遗传学家Ritossa发现的。这是一类在生物进化过程中高度保守并广泛存在于原核及真核生物中的蛋白质。•定义:热休克蛋白是生物受到环境中物理、化学、生物、精神等刺激时发生应激反映而合成的蛋白质。热休克蛋白的分类•Hsp100家族(分子量约为100kDa)•Hsp90家族(分子量约为83-90kDa)•Hsp70家族(分子量约为66-78kDa)•Hsp60家族(分子量约为60kDa)•小分子量Hsp家族(分子量约为12-43kDa)Hsp90的生物学特性维持信号传导蛋白功能:在细胞发生应激反应时,可以和那些由于环境刺激而使自身构象发生改变的蛋白相互作用,保证蛋白进行适当的折叠并防止蛋白非特异性聚集。调节作用:Hsp90在细胞突变过程中是一个重要的缓冲因子,推测它可能同样可以纠正突变蛋白所发生的错误折叠。目前所知它调控着40种左右蛋白的空间结构和突变。这些蛋白主要可以分为三类:•甾体激素类受体;•丝氨酸/苏氨酸或酪氨酸激酶;•其它蛋白,比如突变型p53,端粒酶hTERT亚基等。所有这些蛋白都是细胞生理、生化变化过程中的重要调控蛋白Hsp90的生物学特性Hsp90的四种亚型Hsp90α(存在于胞浆中)Hsp90β(存在于胞浆中)GRP94(存在于内质网中)Hsp75/肿瘤坏死因子受体相关蛋白TRAP1(主要存在于线粒体基质中)Hsp90的结构特征保守的25kDa的N-末端55kDa的C-末端中间连接区Hsp90的晶体结构Hsp90与癌症Hsp90是一类非常重要的热休克蛋白影响细胞凋亡、免疫作用及肿瘤发生在肿瘤细胞中,Hsp90呈现持续的高诱导表达,其表达比正常细胞高2~10倍。Hsp90的催化循环DNA损伤时,磷酸化的p53激活p21基因转录,p21蛋白结合CDK后,阻止细胞分裂p53抑癌基因之一•p53的突变使其对细胞周期的抑制功能丧失•在大约50%的人类肿瘤中发现p53基因的突变,人类乳腺癌中p53的突变率为15%~60%。•Hsp90与突变型p53结合•突变的p53构象改变暴露出与Hsp90结合的高亲和位点•Hsp90使p53突变体构象稳定,使p53突变体不受蛋白酶降解,延长其半衰期,从而p53突变体在胞内积聚并调控其功能•总之,使p53突变体对细胞周期无抑制作用Hsp90的抑制剂格尔德霉素•格尔德霉素(geldanamycin,GA)属苯醌安莎霉素类抗生素,最初是从吸水链霉菌发酵液中分离得到的。它具有抗肿瘤、抗病毒、调节免疫及抗炎症等多种生物活性。GA对人乳腺癌MDA-MB-435s细胞增殖的...