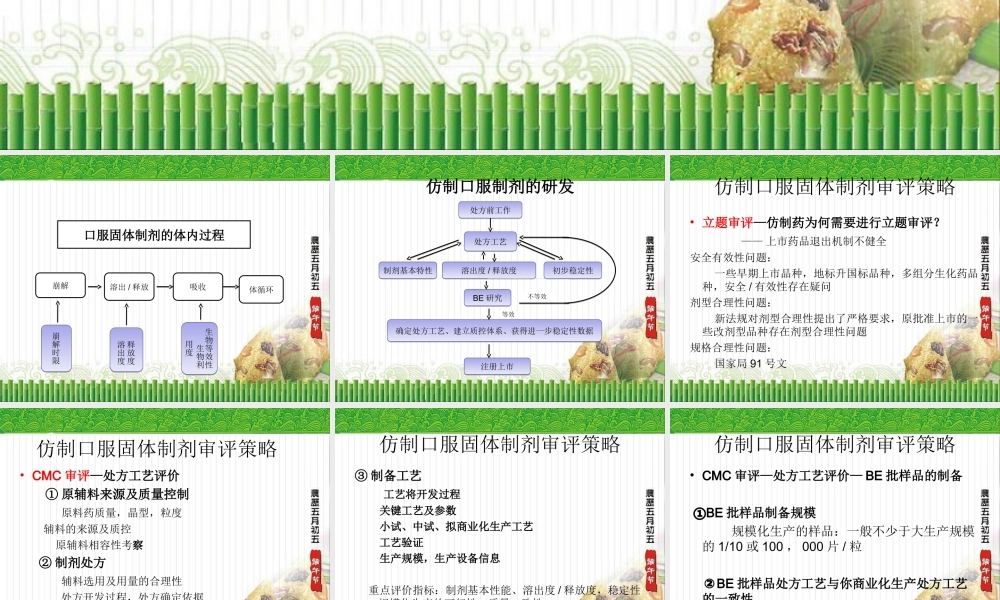
提纲•口服固体制剂体内过程特点•口服固体制剂的研发•仿制口服固体制剂审评策略•溶出度/释放度研究与评价•BE试验与评价口服固体制剂的体内过程崩解溶出/释放吸收体循环崩解时限崩解时限释放度溶出度释放度溶出度生物等效性生物利用度生物等效性生物利用度仿制口服制剂的研发处方前工作处方前工作处方工艺处方工艺溶出度/释放度溶出度/释放度BE研究BE研究确定处方工艺、建立质控体系、获得进一步稳定性数据确定处方工艺、建立质控体系、获得进一步稳定性数据注册上市注册上市制剂基本特性制剂基本特性初步稳定性初步稳定性等效不等效仿制口服固体制剂审评策略•立题审评—仿制药为何需要进行立题审评?——上市药品退出机制不健全安全有效性问题:一些早期上市品种,地标升国标品种,多组分生化药品种,安全/有效性存在疑问剂型合理性问题:新法规对剂型合理性提出了严格要求,原批准上市的一些改剂型品种存在剂型合理性问题规格合理性问题:国家局91号文仿制口服固体制剂审评策略•CMC审评—处方工艺评价①原辅料来源及质量控制原料药质量,晶型,粒度辅料的来源及质控原辅料相容性考察②制剂处方辅料选用及用量的合理性处方开发过程,处方确定依据仿制口服固体制剂审评策略③制备工艺工艺将开发过程关键工艺及参数小试、中试、拟商业化生产工艺工艺验证生产规模,生产设备信息重点评价指标:制剂基本性能、溶出度/释放度,稳定性,规模化生产的可行性,质量一致性仿制口服固体制剂审评策略•CMC审评—处方工艺评价—BE批样品的制备①BE批样品制备规模规模化生产的样品:一般不少于大生产规模的1/10或100,000片/粒②BE批样品处方工艺与你商业化生产处方工艺的一致性仿制口服固体制剂审评策略•CMC审评—质量研究与标准质量研究项目的全面性研究项目的方法学验证(溶出度/释放度、有关物质、含量)溶出度/释放度、有关物质对比研究质量标准项目和限度的可行性省所复检验报告仿制口服固体制剂审评策略•CMC审评—稳定性研究考察指标的设置试验样品制备规模影响因素试验加速试验长期试验包装材料的选择有效期确定仿制口服固体制剂审评策略•BE审评①BE试验样品的提供与管理试验制剂及参比制剂②试验设计受试者参比制剂;给药剂量;给药方式交叉/平行设计生物样本及取样点……仿制口服固体制剂审评策略•③生物样本分析方法建立及验证:特异性、检测线(灵敏度)、定量限、线性、精密度(日内差、日间差)、准确度(回收率)、样品稳定性、基质效...