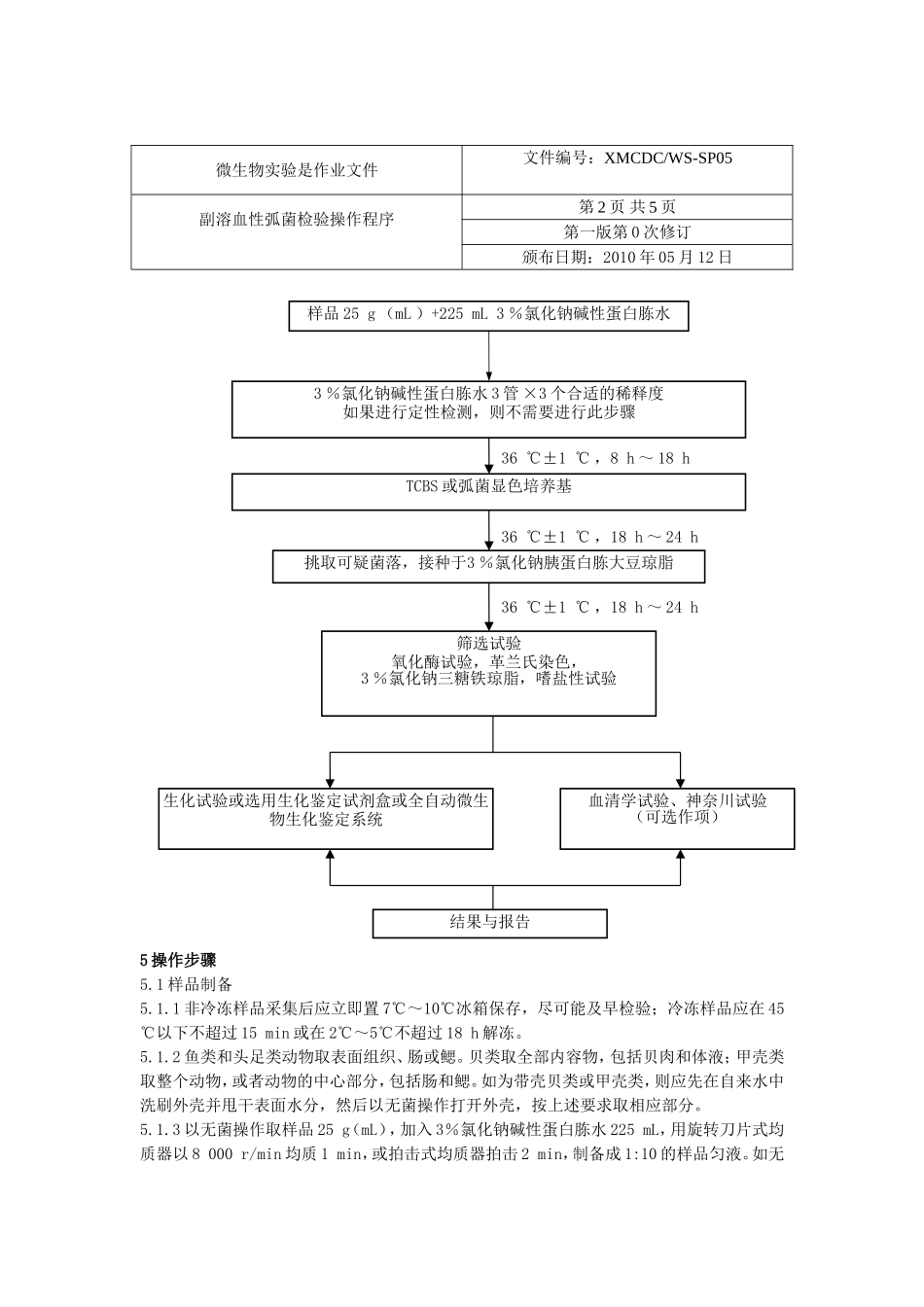
微生物实验是作业文件文件编号:XMCDC/WS-SP05副溶血性弧菌检验操作程序第1页共5页第一版第0次修订颁布日期:2010年05月12日1范围本标准规定了食品中副溶血性弧菌(Vibrioparahaemolyticus)的检验方法。本标准适用于食品中副溶血性弧菌的检验。2设备和材料设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:2.1恒温培养箱:36℃±1℃。2.2冰箱:2℃~5℃、7℃~10℃。2.3恒温水浴箱:36℃±1℃。2.4均质器或无菌乳钵。2.5天平:感量0.1g。2.6无菌试管:18mm×180mm、15mm×100mm。2.7无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。2.8无菌锥形瓶:容量250mL、500mL、1000mL。2.9无菌培养皿:直径90mm。2.10全自动微生物生化鉴定系统。2.11无菌手术剪、镊子。3培养基和试剂3.13%氯化钠碱性蛋白胨水:见附录A中A.1。3.2硫代硫酸盐-柠檬酸盐-胆盐-蔗糖(TCBS)琼脂:见附录A中A.2。3.33%氯化钠胰蛋白胨大豆琼脂:见附录A中A.3。3.43%氯化钠三糖铁琼脂:见附录A中A.4。3.5嗜盐性试验培养基:见附录A中A.5。3.63%氯化钠甘露醇试验培养基:见附录A中A.6。3.73%氯化钠赖氨酸脱羧酶试验培养基:见附录A中A.7。3.83%氯化钠MR-VP培养基:见附录A中A.8。3.93%氯化钠溶液:见附录A中A.9。3.10我妻氏血琼脂:见附录A中A.10。3.11氧化酶试剂:见附录A中A.11。3.12革兰氏染色液:见附录A中A.12。3.13ONPG试剂:见附录A中A.13。3.14Voges-Proskauer(V-P)试剂:见附录A中A.14。3.15弧菌显色培养基。3.16生化鉴定试剂盒。4检验程序副溶血性弧菌检验程序见图1。微生物实验是作业文件文件编号:XMCDC/WS-SP05副溶血性弧菌检验操作程序第2页共5页第一版第0次修订颁布日期:2010年05月12日5操作步骤5.1样品制备5.1.1非冷冻样品采集后应立即置7℃~10℃冰箱保存,尽可能及早检验;冷冻样品应在45℃以下不超过15min或在2℃~5℃不超过18h解冻。5.1.2鱼类和头足类动物取表面组织、肠或鳃。贝类取全部内容物,包括贝肉和体液;甲壳类取整个动物,或者动物的中心部分,包括肠和鳃。如为带壳贝类或甲壳类,则应先在自来水中洗刷外壳并甩干表面水分,然后以无菌操作打开外壳,按上述要求取相应部分。5.1.3以无菌操作取样品25g(mL),加入3%氯化钠碱性蛋白胨水225mL,用旋转刀片式均质器以8000r/min均质1min,或拍击式均质器拍击2min,制备成1:10的样品匀液。如无36℃±1℃,18h~24h36℃±1℃,18h~24h36℃±1℃,8h~...