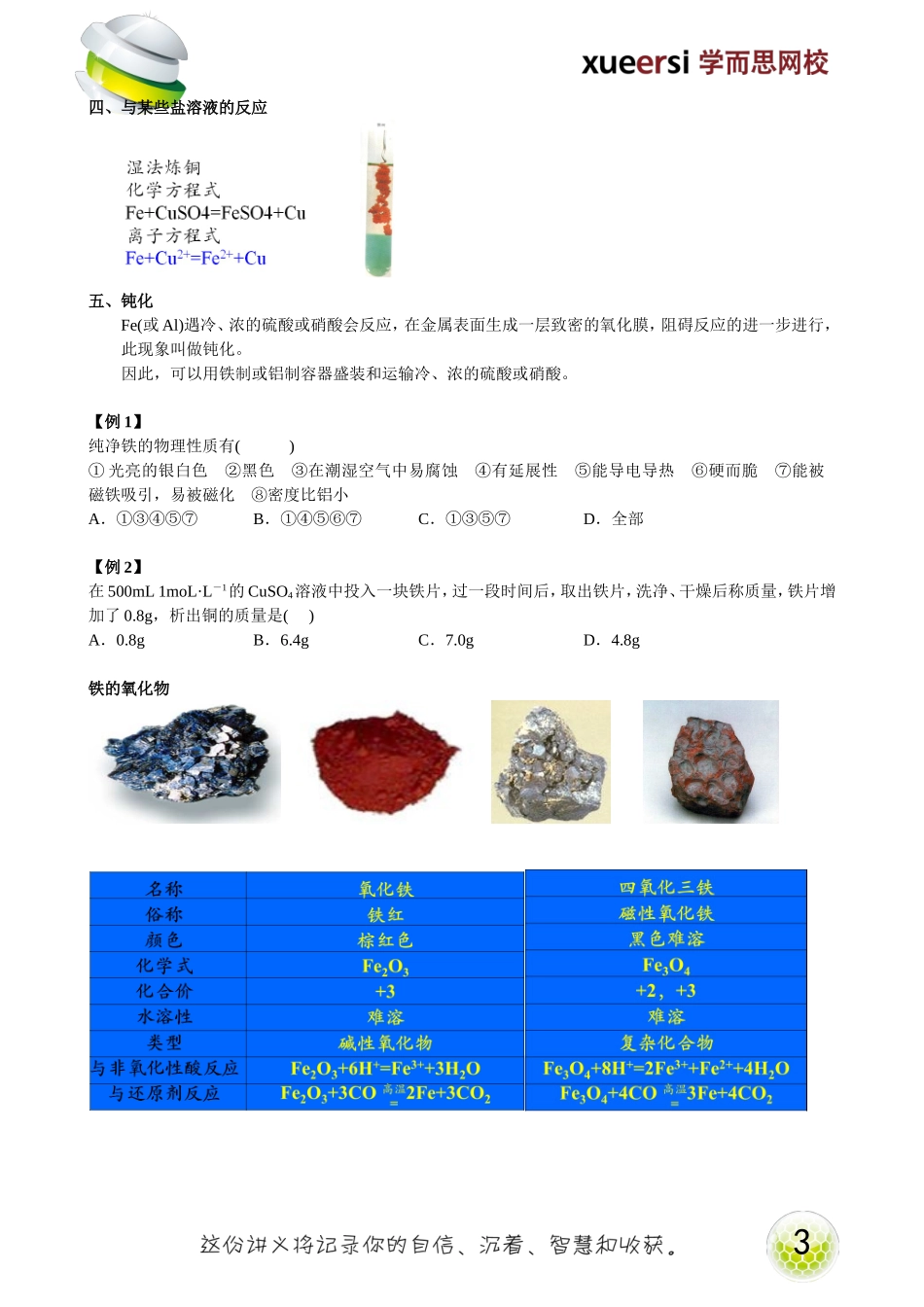
1铁的使用铁的存在与物理性质1.存在铁在地壳中的含量仅次于氧,硅和铝,居第4位,在金属中居第2位。铁和铁的化合物22.物理性质特性:可以被磁铁吸引,并可被磁化二、与非氧化性酸反应Fe+2HCl=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑Fe+2H+=Fe2++H2↑三、与H2O(g)反应3四、与某些盐溶液的反应五、钝化Fe(或Al)遇冷、浓的硫酸或硝酸会反应,在金属表面生成一层致密的氧化膜,阻碍反应的进一步进行,此现象叫做钝化。因此,可以用铁制或铝制容器盛装和运输冷、浓的硫酸或硝酸。【例1】纯净铁的物理性质有()①光亮的银白色②黑色③在潮湿空气中易腐蚀④有延展性⑤能导电导热⑥硬而脆⑦能被磁铁吸引,易被磁化⑧密度比铝小A.①③④⑤⑦B.①④⑤⑥⑦C.①③⑤⑦D.全部【例2】在500mL1moL·L-1的CuSO4溶液中投入一块铁片,过一段时间后,取出铁片,洗净、干燥后称质量,铁片增加了0.8g,析出铜的质量是()A.0.8gB.6.4gC.7.0gD.4.8g铁的氧化物4【例3】现有CuO和Fe2O3组成的混合物ag,向其中加入2mol·L—1的硫酸溶液50mL,恰好完全反应。若将ag该混合物在足量H2中加热,使其充分反应,冷却后剩余固体质量为()A.1.6agB.(a-1.6)gC.(a-3.2)gD.1.6g【例4】上海世博园地区的一座大型钢铁厂搬迁后,附近的居民将不再受到该厂产生的红棕色烟的困扰。你估计这一空气污染物可能含有()A.FeO粉尘B.Fe2O3粉尘C.Fe粉尘D.碳粉铁的氢氧化物5铁盐的性质1.氧化性2FeCl3+Cu=2FeCl2+CuCl22Fe3++Cu=2Fe2++Cu2+该反应用于刻蚀铜制电路板2FeCl3+2KI=2FeCl2+I22Fe3++2I-=2Fe2++I22.与KSCN(aq)反应【例5】在FeCl3溶液中,加入过量的铜粉,充分反应后,溶液中存在的金属离子是()A.Fe2+和Cu2+B.Fe3+C.Cu2+D.Fe2+【例6】下列可用于检验实验室久置的FeSO4溶液是否含有Fe3+的试剂是()A.石蕊试液B.酚酞试液C.新制氯水D.KSCN溶液【例7】只用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区分开,该试剂是()A.BaCl2溶液B.FeCl2溶液C.FeCl3溶液D.Fe(NO3)3溶液6【例8】硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质()A.锌粉B.镁粉C.铁粉D.铝粉【例9】把Fe、Fe2O3、Cu的混合物放入稀硫酸中加热,充分反应后残渣中仍有铁和铜,则溶液中含有()A.Fe3+、Fe2+、SO42—B.Cu2+、Fe2+、SO42—C.H+、Fe3+、SO42—D.Fe2+、SO42—【例10】随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是()A.无水硫酸铜、蔗糖B.生石灰、硫酸亚铁C.食盐、硫酸亚铁D.生石灰、食盐