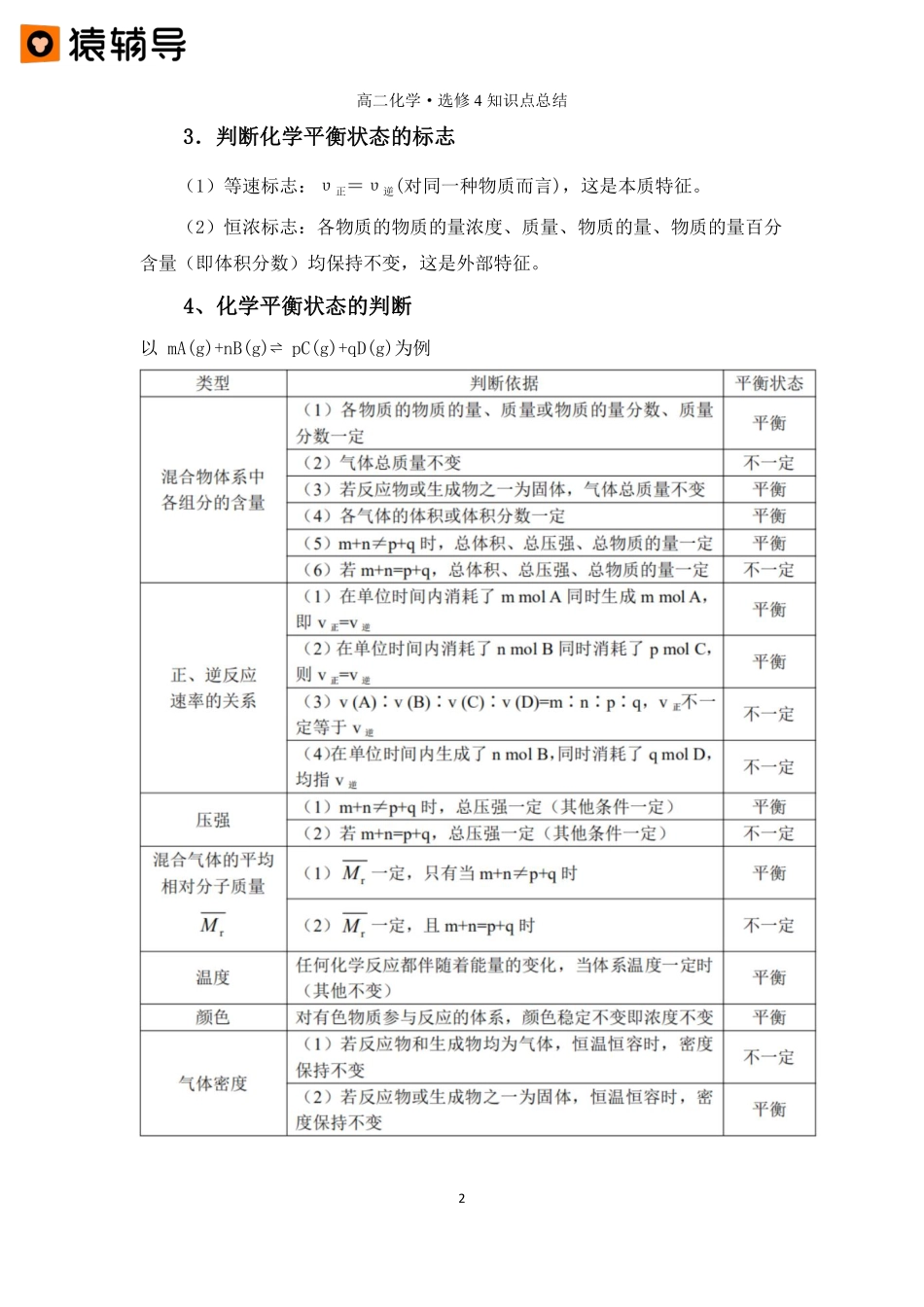
高二化学·选修4知识点总结1第三讲化学平衡及其应用一、化学平衡状态1.化学平衡状态的含义:指在一定条件下的可逆反应中,正反应和逆反应的速率相等,反应体系中所有反应物和生成物的质量(或浓度)保持不变的状态。2.化学平衡状态的特征:“逆、等、定、动、变、同”【要点诠释】(1)“逆”:可逆反应。(2)“等”:υ正=υ逆对于同种物质:该物质的生成速率=消耗速率;对于不同物质:要将不同物质表示的速率按照速率比等于系数比折算成同一物质表示的速率,且满足上述条件(υ正=υ逆)。(3)“定”:条件一定时,反应体系中所有反应物和生成物的浓度(或质量、物质的量、物质的量百分含量、反应物转化率等)不再随时间变化。(4)“动”:正逆反应都在进行,对同一物质:υ正=υ逆≠0,体系处于动态平衡。(5)“变”:反应条件改变,正逆反应速率可能不再相等,平衡就会发生移动,直至建立新的平衡,正逆反应速率又达到相等。(6)“同”:一个特定化学平衡的建立与反应途径无关(等效平衡)。对于同一个可逆反应,只要条件相同(温度、浓度、压强),不论从正反应方向开始,还是从逆反应方向开始,或从正、逆两个方向同时开始,只要投料相当,均能达到同一平衡状态。例如:相同条件下,对于可逆反应2SO2(g)+O2(g)⇌2SO3(g),投料2molSO2和1molO2或投料2molSO3,最终达到同一平衡状态。高二化学·选修4知识点总结23.判断化学平衡状态的标志(1)等速标志:υ正=υ逆(对同一种物质而言),这是本质特征。(2)恒浓标志:各物质的物质的量浓度、质量、物质的量、物质的量百分含量(即体积分数)均保持不变,这是外部特征。4、化学平衡状态的判断以mA(g)+nB(g)⇌pC(g)+qD(g)为例高二化学·选修4知识点总结3二、化学平衡常数1.定义在一定温度下,当一个可逆反应达到化学平衡状态时,生成物浓度以反应方程式中计量数为指数的幂的乘积与反应物浓度以反应方程式中计量数为指数的幂的乘积之比是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),用K表示。对于可逆反应mA(g)+nB(g)⇌pC(g)+qD(g),在一定温度下无论反应物的起始浓度如何,反应达到平衡状态后,总有:【要点诠释】(1)上式中c(A)、c(B)、c(C)、c(D)是各物质处于化学平衡时的物质的量浓度。(2)温度一定时,可逆反应无论从正反应开始,还是从逆反应开始,无论反应物起始浓度大小,K是一个常数。而且K只与温度有关。(3)对于在溶液中进行的反应,溶剂的浓度是一...