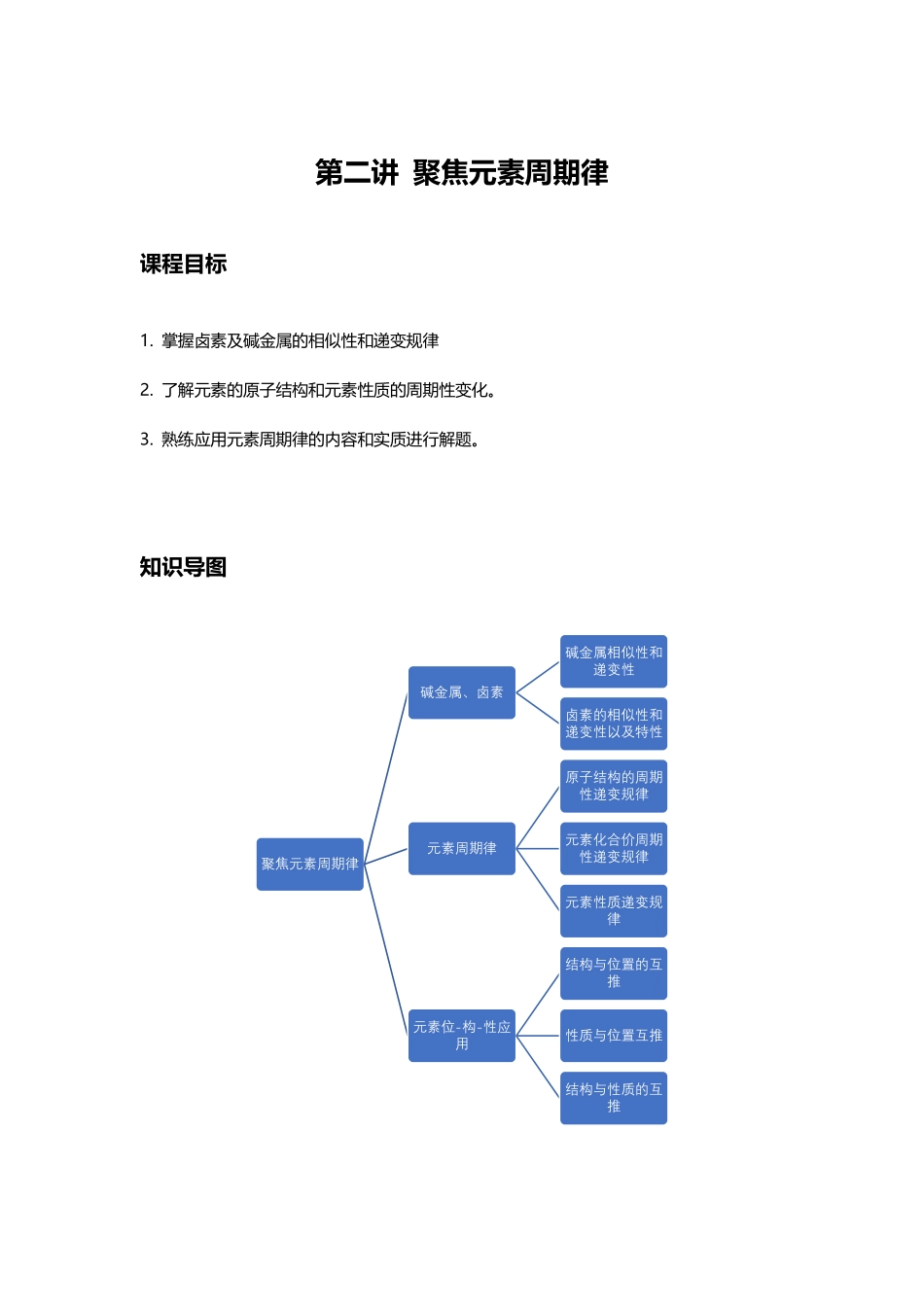
第二讲聚焦元素周期律课程目标1.掌握卤素及碱金属的相似性和递变规律2.了解元素的原子结构和元素性质的周期性变化。3.熟练应用元素周期律的内容和实质进行解题。知识导图聚焦元素周期律碱金属、卤素碱金属相似性和递变性卤素的相似性和递变性以及特性元素周期律原子结构的周期性递变规律元素化合价周期性递变规律元素性质递变规律元素位-构-性应用结构与位置的互推性质与位置互推结构与性质的互推模块一碱金属、卤素知识精讲一、碱金属相似性和递变性1.相似性(R表示碱金属元素)原子都容易失去最外层的一个电子,化学性质活泼,它们的单质都具有较强的还原性,它们都能与氧气等非金属单质及水反应。碱金属与水反应的通式为2R+2H2O===2ROH+H2↑。2.递变性随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,碱金属元素的原子失电子能力逐渐增强,金属性逐渐增强。(1)(2)与O2的反应越来越剧烈,产物更加复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成Na2O2,而K与O2反应能够生成KO2等。(3)与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。(4)最高价氧化物对应水化物的碱性逐渐增强,CsOH的碱性最强。二、卤素的相似性和递变性以及特性1.相似性(X表示卤素元素)卤素原子都容易得到一个电子使其最外层达到8个电子的稳定结构,它们的单质都是活泼的非金属单质,都具有较强的氧化性。(1)与H2反应:X2+H2=====一定条件2HX。(2)与活泼金属(如Na)反应:2Na+X2=====点燃2NaX。(3)与H2O反应X2+H2O===HX+HXO(X=Cl、Br、I);2F2+2H2O===4HF+O2。(4)与NaOH溶液反应X2+2NaOH===NaX+NaXO+H2O(X=Cl、Br、I)。2.递变性(X表示卤素元素)随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,卤素原子得电子的能力逐渐减弱,非金属性逐渐减弱。(1)(2)与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,即:稳定性:HF>HCl>HBr>HI;还原性:HF<HCl<HBr<HI。(3)卤素单质与变价金属(如Fe)反应时,F2、Cl2、Br2生成高价卤化物(如FeX3),而I2只能生成低价卤化物(如FeI2)。(4)氢化物都易溶于水,其水溶液酸性依次增强,氢化物中HCl、HBr、HI的熔、沸点依次升高,HF的熔、沸点最高。(5)最高价氧化物的水化物的酸性逐渐减弱,即酸性:HClO4>HBrO4>HIO4,HClO4是已知含氧酸中酸性最强的酸。3.卤素的特性(1)氟元素无正价,无...