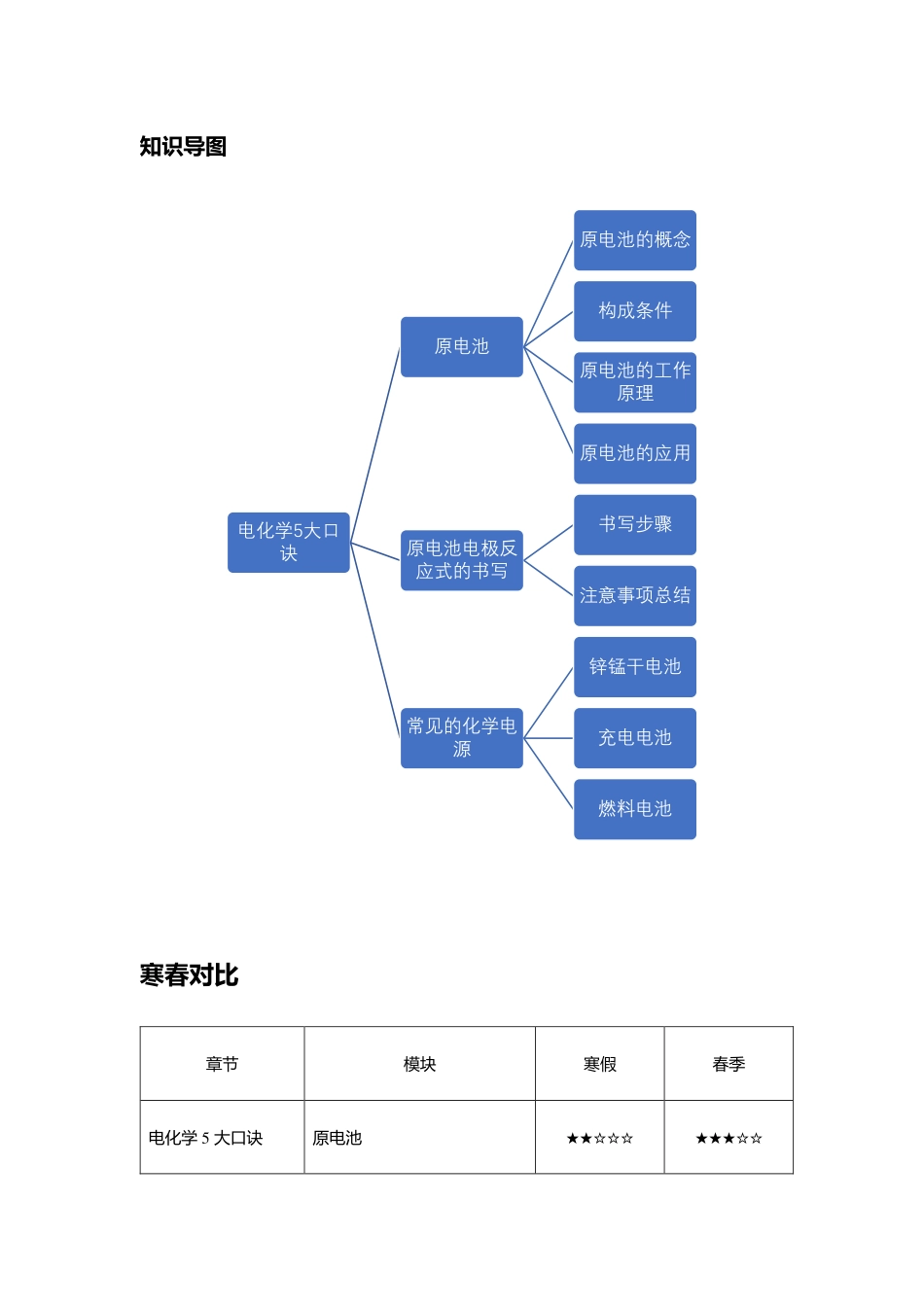
第五讲电化学五大口诀课程目标1.知道原电池是利用氧化还原反应将化学能转化为电能的装置,通过实验会说明原电池的原理,以及判断原电池的正、负极。2.会正确书写电极反应式,熟知原电池的应用。3.知道干电池、充电电池、燃料电池等发展中的化学电源的特点。4.认识提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。知识导图寒春对比章节模块寒假春季电化学5大口诀原电池★★☆☆☆★★★☆☆电化学5大口诀原电池原电池的概念构成条件原电池的工作原理原电池的应用原电池电极反应式的书写书写步骤注意事项总结常见的化学电源锌锰干电池充电电池燃料电池原电池电极反应式的书写—★★☆☆☆常见的化学电源★☆☆☆☆★★☆☆☆大招速递负氧正还正进负出正正负负确定一剂一产物氧还配平按步走模块一原电池知识精讲一、原电池的概念:是将化学能转化为电能的装置;原电池的反应本质是氧化还原反应。二、构成条件1.反应:原电池反应必须是自发的氧化还原反应。2.电极:具有活动性不同的两个电极(金属与金属或金属与能导电的非金属)。3.溶液:两电极均插入电解质溶液中。4.回路:形成闭合回路。三、原电池的工作原理1.工作原理原电池总反应式:Zn+2H+=Zn2++H2↑。2.能量转化过程原电池在工作时,负极失电子,电子通过导线流向正极,被氧化性物质得到,闭合回路中形成电流,化学能转变为电能。【大招点睛】负氧正还正进负出正正负负四、【专题总结】原电池的应用1.加快氧化还原反应的速率因为形成原电池后,氧化反应和还原反应分别在两极进行,使溶液中的粒子运动时相互间的干扰减小,所以反应速率增大。2.比较金属活动性的强弱例如:有两种金属a、b,用导线相连后插入稀硫酸中,能溶解的金属活动性较强,表面出现较多气泡的金属活动性较弱。3.用于金属的防护原理:使被保护的金属制品作原电池的正极而得到保护。实例:要保护一个铁质的输水管道,可用导线将其与锌块相连,使锌作原电池的负极,铁质管道作原电池的正极。4.设计原电池根据原电池的构成条件,可把自发的氧化还原反应设计为原电池。【注意】原电池正负极判断的注意点①原电池中发生氧化反应的一极为负极,发生还原反应的一极为正极。②判断电极时,不能简单地依据金属的活泼性来判断,要看反应的具体情况,例如镁、铝电极在氢氧化钠溶液中形成原电池时,虽然镁比铝更活泼,但只有铝能和氢氧化钠溶液反应而失去电子,因此铝为负极,镁为正极。模块二原电池电极反应式的书写知...