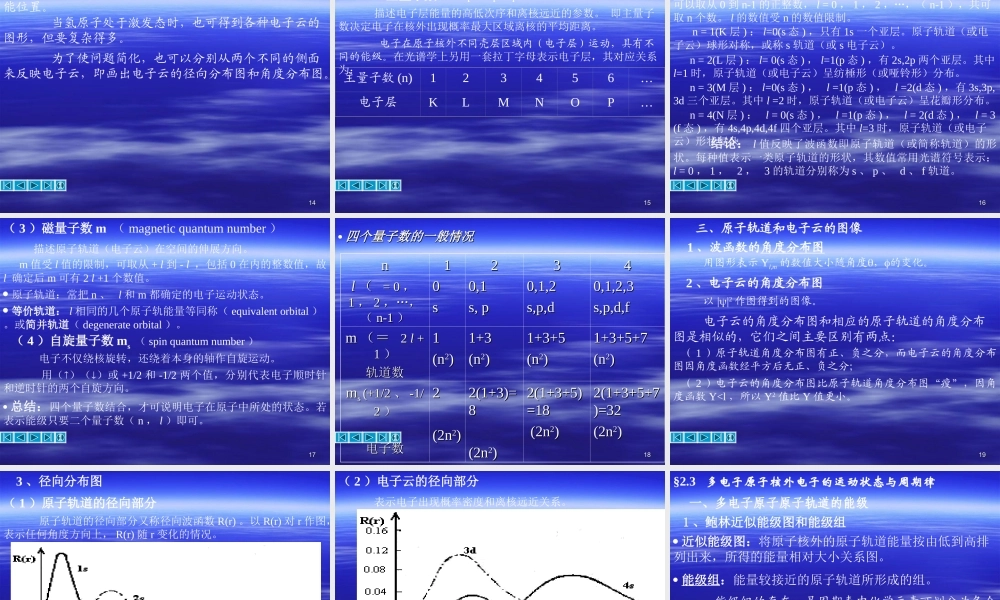
11原子结构和元素周期律§2.3多电子原子核外电子的运动状态与周期律§2.1原子结构理论的发展概述§2.2原子的量子力学模型§2.4元素的性质与原子结构的关系22本章要求1、了解近代微观粒子结构的初步概念;了解微观粒子的波粒二象性、能量量子化和统计解释。2、了解波函数、原子轨道、电子云、能级的基本概念。3、掌握n,l,m,ms四个量子数及其物理意义;理解s,p,d原子轨道和电子云角度分布图的特征。4、理解原子轨道的能级组,屏蔽效应理论及有效核电荷的计算。5、掌握核外电子的分布原则及电子分布式的书写,元素周期律和周期表,元素性质与原子结构的关系;理解原子半径、镧系收缩、元素的电离能、电子亲和能、电负性、氧化数、金属性和非金属性的概念及其周期变化规律。第一章原子结构和元素周期律33一、含核的原子模型§2.1原子结构理论的发展概述古中国和古希腊的物质结构学说;道尔顿的原子学说(1808):原子不可分;卢瑟福的含核原子模型(1911)。二、玻尔的原子模型(一)氢原子光谱(二)玻尔氢原子理论(1913)原子结构理论的几点假设:44稳定轨道(stableorbital)具有固定的能量,沿此轨道运动的电子,称为处在定态的电子,它不吸收能量,也不发射能量1、在原子中,电子不是在任意轨道上绕核运动,而是在一些符合一定条件(从量子论导出的条件)的轨道上运动。2、电子在不同轨道上运动时具有不同的能量,通常把这些具有不连续能量的状态称为能级(energylevel)。玻尔氢原子能级为:n称为量子数(quantumnumber),其值可取1,2,3…等任何正整数。B为常数,其值等于2.1810-18J。3、当电子从某一轨道跃迁到另一轨道时,有能量的吸收或放出。其频率可由两个轨道的能量差E决定:E2-E1=E=hh为普朗克常量,其数值为6.626181034Js。2nBE55优点:(三)对玻尔理论的评价首先引入量子化的概念,解释了氢原子光谱为不连续光谱。不足:(1)未能完全冲破经典力学连续概念,只是勉强加进了一些人为的量子化条件和假定。(3)未考虑其运动的波动性,采用了宏观轨道的概念。(2)不能解释多电子原子(核外电子数大于1的原子)、分子或固体的光谱。亦不能解释氢光谱的每条谱线实际上还可分裂为两条谱线的现象。66稳定轨道(四)几个基本概念在原子中一些符合一定条件(从量子论导出的条件)的轨道。稳定轨道的特点——具有固定的能量。定态电子能级——具有不连续能量的状态。稳定轨道上运动的电子,不吸收...