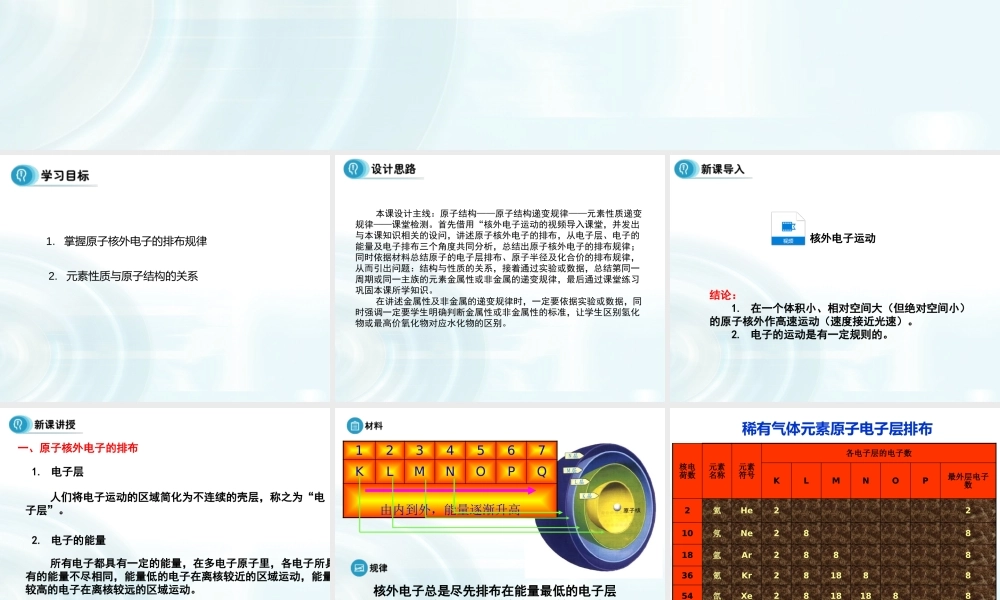
第一章元素周期表第2节元素周期律(课时1)1.掌握原子核外电子的排布规律2.元素性质与原子结构的关系本课设计主线:原子结构——原子结构递变规律——元素性质递变规律——课堂检测。首先借用“核外电子运动的视频导入课堂,并发出与本课知识相关的设问,讲述原子核外电子的排布,从电子层、电子的能量及电子排布三个角度共同分析,总结出原子核外电子的排布规律;同时依据材料总结原子的电子层排布、原子半径及化合价的排布规律,从而引出问题:结构与性质的关系,接着通过实验或数据,总结第同一周期或同一主族的元素金属性或非金属的递变规律,最后通过课堂练习巩固本课所学知识。在讲述金属性及非金属的递变规律时,一定要依据实验或数据,同时强调一定要学生明确判断金属性或非金属性的标准,让学生区别氢化物或最高价氧化物对应水化物的区别。结论:1.在一个体积小、相对空间大(但绝对空间小)的原子核外作高速运动(速度接近光速)。2.电子的运动是有一定规则的。核外电子运动人们将电子运动的区域简化为不连续的壳层,称之为“电子层”。1.电子层2.电子的能量所有电子都具有一定的能量,在多电子原子里,各电子所具有的能量不尽相同,能量低的电子在离核较近的区域运动,能量较高的电子在离核较远的区域运动。3.核外电子的排布规律(分析表1-2)一、原子核外电子的排布1234567KLMNOPQ由内到外,能量逐渐升高核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(能量最低原理)。稀有气体元素原子电子层排布核电荷数元素名称元素符号各电子层的电子数KLMNOP最外层电子数2氦He2210氖Ne28818氩Ar288836氪Kr28188854氙Xe2818188886氡Rn2818321888各层最多电子数281832??(1)各电子层最多能容纳的电子数为2n2(2)最外层电子数不能超过8(当K层为最外层时不能超过2)。(3)次外层电子数不能超过18,倒数第三层电子数不能超过32。(1)各电子层最多能容纳的电子数为2n2(2)最外层电子数不能超过8(当K层为最外层时不能超过2)。(3)次外层电子数不能超过18,倒数第三层电子数能超过32。(4)核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(能量最低原理)。核外电子的排布规律:a.四条规律相互制约b.最外电子层中排满8个电子(He为2个电子)时,为相对稳定结构,其它为不稳定结构1.判断下列原子结构示意图是否正确?为什么?A、B、D、C、××××2.根据下列...