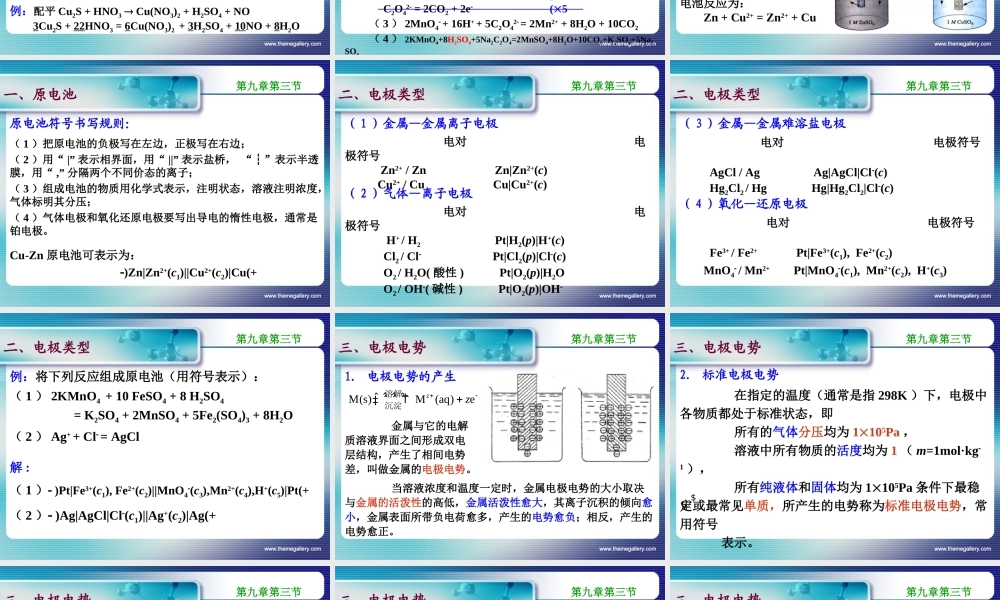
www.themegallery.com第一节基本概念第二节氧化还原方程式的配平第三节原电池与电极电势第四节影响电极电势的因素第五节电极电势的应用第六节氧化还原滴定法第九章氧化还原反应及其滴定法第九章www.themegallery.com一、氧化数氧化数是指某元素一个原子的形式电荷数。形式上得一电子氧化数为1;形式上失一电子氧化数为+1。第一节基本概念第九章第一节确定氧化数的规则有:(1)在单质(如Cu,H2,O2等)中,元素的氧化数为0;(2)在中性分子中,元素的氧化数总和为0;(3)在单离子中,氧化数等于离子的电荷数(如Cu2+);(4)H氧化数为+1,O为2。在NaH类化合物中,H为1;H2O2类化合物中,O为1;KO2类化合物中,O为1/2;OF2类化合物中,O为+2。www.themegallery.com注意:化合价与氧化数的区别与联系化合价反映了一种元素的原子与其它元素的原子化合的数量比。氧化数是指形式上的得失电子数。在离子型化合物中,两者是一致的;在共价型化合物中,两者是不同:化合价=共价键数目第一节基本概念第九章第一节如CH4CH3ClCH2Cl2CHCl3CCl4化合价:44444氧化数:420+2+4从取值上来看,化合价只能为整数,而氧化数可取整数或分数。如,Fe3O4中Fe的氧化数为+8/3。www.themegallery.com第一节基本概念二、氧化和还原物质得到电子,元素氧化数降低的过程,称还原作用;物质失去电子,元素氧化数升高的过程,称氧化作用。Cu2++2eCu还原半反应ZnZn2++2e氧化半反应得失电子的两个半反应组成一个完全的氧化还原反应,过程中得失电子的总数必相等。Cu2++Zn=Cu+Zn2+氧化剂还原剂还原产物氧化产物氧化还原电对用Ox/Red表示,如Cu2+/Cu,Zn2+/Zn,MnO4/Mn2+,AgCl/Ag。第九章第一节www.themegallery.com第二节氧化还原方程式的配平第九章第二节一、氧化数法原则:氧化数降低总数=升高总数步骤:(1)写出反应方程式;(2)标出相关元素的氧化数;(3)根据氧化剂与还原剂氧化数变化总数相等的原则,确定氧化剂和还原剂的计量系数;(4)配平H、O以外的原子数;(5)配平H和O(添加H+、OH或H2O)。例:配平Cu2S+HNO3Cu(NO3)2+H2SO4+NO3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO+8H2Owww.themegallery.com第九章第二节第二节氧化还原方程式的配平二、离子电子法原则:得电子总数=失电子总数步骤:(1)写出反应的基本离子反应式;(2)写成两个半反应并配平;(3)根据得失电子数相等,把两个半反应相加成总反应。例:写出KMnO4在酸性条件下和Na2C2O...