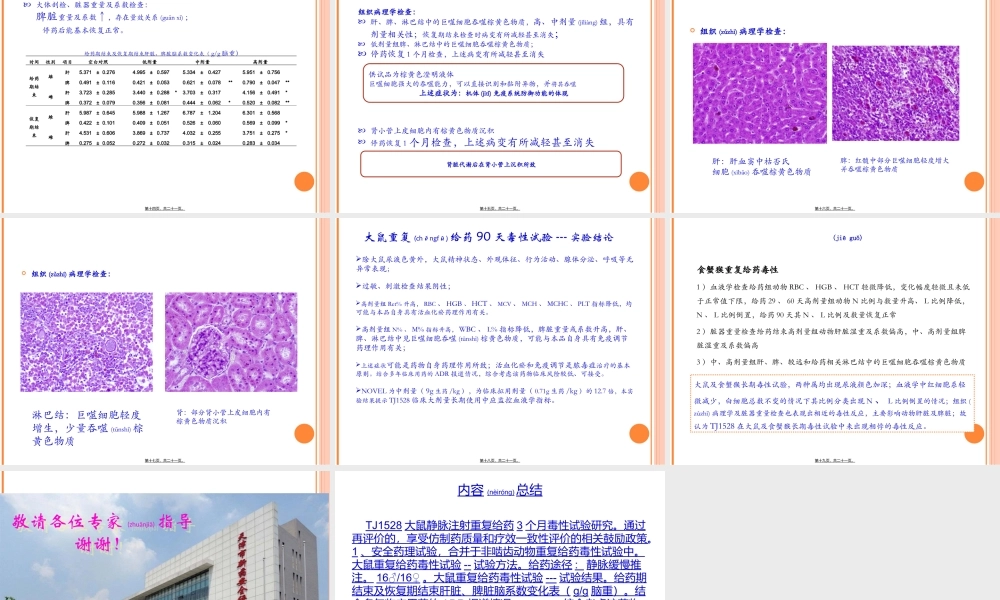
TJ1528大鼠静脉注射重复(chóngfù)给药3个月毒性试验研究天津药物(yàowù)研究院新药评价有限公司胡金芳第一页,共二十一页。汇报(huìbào)目录试验背景1试验结果3试验结论4试验方法27第二页,共二十一页。基本原则(yuánzé):成分清晰纯净度高疗效有充分证据毒副作用明确中药(zhōngyào)注射剂特点:成分复杂未知水中不稳定和不溶性微粒问题:局部栓塞性损伤和坏死,如肉芽肿、微血管阻塞、炎症反应等临床使用环节问题多:发烧用清开灵,感冒用双黄连,心血管疾病用香丹针过敏原多疗效不确切不良反应事件多注射剂第三页,共二十一页。9月CFDA要求召回喜炎平、红花注射液,全国停用。10月8日,中办、国办印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,其中第十一条,第二十五条,让中药注射液的安全性问题再次成为热议焦点。(十一)严格药品注射剂审评审批。严格控制口服制剂改注射制剂,口服制剂能够满足临床需求的,不批准注射制剂上市。严格控制肌肉注射制剂改静脉注射制剂,肌肉注射制剂能够满足临床需求的,不批准静脉注射制剂上市。大容量注射剂、小容量注射剂、注射用无菌粉针之间互改剂型的申请,无明显临床优势的不予批准。(二十五)开展药品注射剂再评价。根据药品科学进步情况,对已上市药品注射剂进行再评价,力争用5至10年左右时间基本完成。上市许可持有人须将批准上市时的研究情况、上市后持续研究情况等进行综合分析,开展产品成份、作用机理和临床疗效研究,评估其安全性、有效性和质量可控性。通过再评价的,享受仿制(fǎngzhì)药质量和疗效一致性评价的相关鼓励政策。第四页,共二十一页。1不管是西药还是中药,都会有毒副作用和不良反应,国内外均如此。2中药注射剂的不良反应之所以争议大,主要在于大多数中药注射剂不良反应类型的不确定性以及不良反应发生率的数据缺乏,前者会造成抢救的复杂性以及结果的不可控,后者会增加临床应用的风险。第五页,共二十一页。中药注射剂突破了传统(chuántǒng)剂型,直接进入体循环,较传统(chuántǒng)剂型,风险明显加大;传统(chuántǒng)用药经验对注射剂处方组成配伍及配比的指导作用有限,需要通过充分研究阐明其安全性、有效性,保证其质量可控性。第六页,共二十一页。成分:红花、赤芍、川芎、丹参、当归等中药材的提取物成方依据:以血府逐瘀汤为基础,在“菌毒炎并治”的理论指导下,根据“三证三法”辨证原则研...